
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Nhiệt dung riêng của một chất là một đại lượng vật lý có giá trị bằng nhiệt lượng cần truyền cho một đơn vị khối lượng chất đó để làm tăng nhiệt độ lên 1 °C. Trong hệ thống đo lường quốc tế, đơn vị đo của nhiệt dung riêng là Joule trên kilôgam trên Kelvin, J•kg−1•K−1 hay J/(kg•K), hoặc Joule trên mol trên Kelvin.
+ Nhiệt dung mol đẳng tích (ký hiệu Cv) là nhiệt dung tính trong quá trình biến đổi mà thể tích của hệ không đổi và được tính bằng δ.Q_v chia cho n.dT
+ Nhiệt dung mol đẳng áp (ký hiệu Cp) là nhiệt dung tính trong quá trình biến đổi mà áp suất của hệ không đổi và được tính bằng δ.Q_p chia cho n.dT

Quá trình chậm đông là quá trình khi hạ nhiệt độ xuống dưới nhiệt độ kết tinh mà vẫn chưa xuất hiện kết tinh. Để loại bỏ quá trình chậm đông đó thì hoặc là đưa mầm tinh thể vào để hoặc là khuấy trộn, trong bài thí nghiệm người ta chọn cách là khuấy trộn.

HD:
Trong 1 dung dịch các chất tồn tại ở dạng ion chứ không tồn tại ở phân tử, nên đối với dung dịch trên ta có các ion: Na+(1 mol), Ca2+(1 mol) và OH-(3 mol). Vì vậy CO2 phản ứng chỉ với ion OH- chứ không phản ứng với Na+ hay Ca2+. Do đó không phân biệt CO2 phản ứng với NaOH trước hay Ca(OH)2 trước nhé.
Đối với dạng bài toán CO2 phản ứng với dd có chứa ion OH-, các em phải chú ý đến tỉ lệ giữa số mol OH- và CO2 (k = nOH-/nCO2). Có các trường hợp sau:
TH1: Nếu k \(\le\) 1 tức là 3/a \(\le\) 1, suy ra a \(\ge\) 3 (ở đây a là số mol CO2), thì chỉ xảy ra phản ứng sau:
CO2 + OH- \(\rightarrow\) HCO3- (1)
Trường hợp này không thu được kết tủa, nên số mol kết tủa thu được = 0.
TH2: Nếu 1 < k < 2, tức là 1 < 3/a < 2, hay 1,5 < a < 3, thì xảy ra đồng thời 2 phản ứng sau:
CO2 + 2OH- \(\rightarrow\) CO32- + H2O
CO2 + OH- \(\rightarrow\) HCO3-
Trong trường hợp này thì số mol CO32- thu được = 3 - a mol (vì tổng số mol CO2 = a và tổng số mol OH- = 3 mol). Do đó, có phản ứng sau:
Ca2+ +CO32- \(\rightarrow\) CaCO3 (kết tủa trắng)
1 mol 3-a mol
Nếu 1 < 3-a, tức là 1,5 < a < 2 thì số mol kết tủa thu được = 1 mol. Nếu 3-a \(\le\) 1, tức là 2 \(\le\) a < 3, thì số mol kết tủa thu được = 3-a mol.
TH3: Nếu k \(\ge\) 2 tức là 3/a \(\ge\) 2, hay a \(\le\) 1,5 thì chỉ xảy ra phản ứng sau:
CO2 + 2OH- \(\rightarrow\) CO32-
Trường hợp này số mol OH- dư so với CO2 nên số mol CO32- thu được = số mol CO2 = a mol.
Ca2+ + CO32- \(\rightarrow\) CaCO3
1 mol a mol
Nếu 1 < a \(\le\) 1,5 thì số mol kết tủa thu được = 1 mol. Nếu a \(\le\) 1 thì số mol kết tủa thu được = a mol.
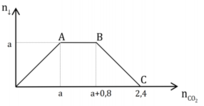
Như vậy qua các trường hợp trên có thể tóm tắt lại như sau:
Đặt y = số mol kết tủa. Ta có:
1) nếu 0 < a \(\le\) 1 thì y = a
2) nếu 1 < a < 2 thì y = 1
3) nếu 2 \(\le\) a < 3 thì y = 3-a
4) nếu a \(\ge\) thì y = 0.
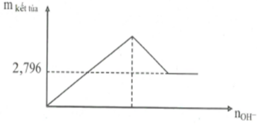
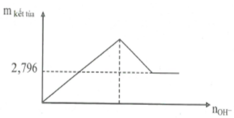
Từ đó có thể vẽ đồ thị biểu diễn sự phụ thuộc của x vào a như sau:

Chọn B.
- Các phương trình phản ứng:
B a 2 + + S O 4 2 - → B a S O 4 ( k t )
3 O H - + A l 3 + → A l ( O H ) 3
A l ( O H ) 3 + O H - → A l O 2 - + H 2 O (tan vào dung dịch)
- Trên đồ thị, ta thấy: n B a S O 4 = m B a S O 4 233 = 2 , 796 233 = 0 , 012 m o l
- Để lượng kết tủa không đổi thì: n O H - m i n = 4 n A l 3 +
Với: n A l 3 + = 2 / 3 n S O 4 2 - = 2 / 3 . 0 , 012 = 0 , 008 m o l ⇒ n O H - m i n = 4 . 0 , 008 = 0 , 032 m o l
- Thể tích dung dịch Ba(OH)2 nhỏ nhất cần dùng là:
V B a ( O H ) 2 = 0 , 032 2 . 0 , 2 = 0 , 08 lít = 80 ml.

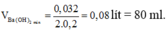



đlg/l chính là nồng độ đương lượng gam hay còn ký hiệu là CN hoặc N, còn nồng độ mol/l ký hiệu là CM hoặc M.
Cách quy đổi giữa 2 nồng độ này thầy đã giải thích trên lớp.
vâng..em hiểu rồi ạ :/ :/