Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Sục khí Cl2 vào dung dịch Na2CO3 có khí CO2 thoát ra, màu vàng
lục của khí Cl2 nhạt dần
- Đầu tiên khí Cl2 tác dụng với H2O có trong dung dịch muối Na2CO3
\(Cl_2+H_2O\rightarrow HCl+HClO\)
- Sau đó HCl sinh ra mới phản ứng với Na2CO3
\(Na_2CO_3+2HCl\rightarrow2NaCl+CO_2+H_2O\)
- Sau khi có khí CO2 sinh ra thì dẫn khí CO2 vào dd Ca(OH)2. Khí
CO2 lúc này phản ứng với dd Ca(OH)2 tạo thành kết tủa trắng
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)
Sục clo vào dd Na2CO3, clo phản ứng với nước tạo nước clo. Nước clo có chứa axit nên tác dụng với Na2CO3 tạo khí CO2. Sục CO2 vào nước vôi trong tạo kết tủa CaCO3 nên bị đục.
\(Cl_2+H_2O⇌HCl+HClO\)
\(Na_2CO_3+2HCl\rightarrow2NaCl+CO_2+H_2O\)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)

1. Hãy giải thích tại sao nước của H2S để lâu trong kk bị vấn đục. Viết pt hóa học minh họa.
H2S+H2O->H2O+S
2. Vì sao các đồ vật bằng bạc để lâu ngày trong kk bị xám đen.
vì chúng td với H2S
H2S+Ag+O2->Ag2S+h2O
3. Xác định số oxi hóa của lưu huỳnh trong các chất sau: H2S, SO2, H2SO4, S
H2S=>Sht: -2
, SO2=>S:+4
, H2SO4=>S+6
, S=>S:+0
1) Dung dịch H2S để lâu ngày bị vẩn đục do bị O2 trong không khí oxi hoá giải phóng ra không tan trong nước
2H2S+O2 => 2S↓+2H2O
2)Do bạc tác dụng với khí O2 và H2S có trong không khí tạo ra bạc sunfua (Ag2S) màu đen.
4 Ag + O2 + 2 H2S => 2Ag2S + 2 H2O
Khi bạc sunfua gặp nước sẽ có một lượng rất nhỏ đi vào nước thành ion Ag+. Ion Ag+ có tác dụng diệt khuẩn rất mạnh, chỉ cần 1/5 tỉ gam bạc trong 1 lít nước cũng đủ diệt vi khuẩn. Không cho vi khuẩn phát triển nên giữ cho thức ăn lâu bị ôi thiu.
3)0, –2, +6, +4.

Đáp án B
Dung dịch H2S để lâu trong không khí xảy ra phản ứng hóa học sau:
2 H 2 S + O 2 → 2 S ↓ + H 2 O
Hiện tượng: Dung dịch H2S để lâu ngày trong không khí thường bị vẫn đục, màu vàng

Nước clo không bảo quản được lâu vì cân bằng hóa học chuyển dịch theo chiều thuận, clo tác dụng từ từ với nước đến hết.

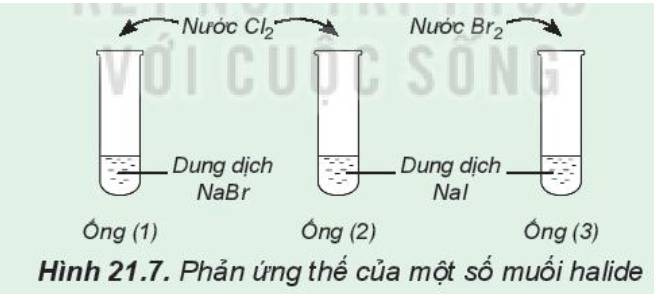
1:
Ống nghiệm (1); dung dịch chuyển sang màu vàng
ống nghiệm (2): dung dịch có màu vàng và có chất rắn màu đen tím
ống nghiệm (3): dung dịch màu vàng nhạt dần và có chất rắn màu đen tím
2: Tính oxi hóa: Cl>Br
=>Cl đẩy Br- ra khỏi dung dịch muối
Tính oxi hóa; Br>I2
=>Br đẩy I- ra khỏi dung dịch muối
=>Tính oxi hóa; Cl2>Br2>I2
3: Để chứng tỏ có sự tạo thành I2 khi cho nước clo (hoặc nước brom) tác dụng với dung dịch sodium iốt ta có thể dùng thuốc thử là hồ tinh bột vì I2 tạo màu xanh đặc trưng với hồ tinh bột.

1. Để dung dịch H2S lâu ngày trong không khí thì có hiện tượng dung dịch dần trở nên vẩn đục và có màu vàng do Oxi trong không khí đã Oxi hóa chậm H2S thành
H2S + O2 --> SO2 + H2O
(Xin lỗi ở trên mik quên ko cân bằng phương trình)
1. Để dung dịch H2S lâu ngày trong không khí thì có hiện tượng dung dịch dần trở nên vẩn đục và có màu vàng do Oxi trong không khí đã Oxi hóa chậm H2S thành
2H2S + 3O2 --> 2SO2 + 2H2O
Dung dịch H 2 S để lâu ngày bị vẩn đục do bị O 2 trong không khí oxi hoá giải phóng ra không tan trong nước
2 H 2 S + O 2 → 2S + 2 H 2 O