Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

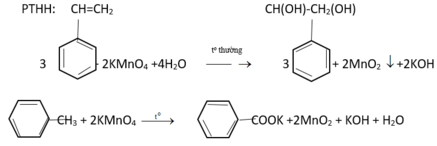
- Cho 3 chất lỏng tác dụng với dung dịch KMnO4 ở nhiệt độ thường, chất nào làm mất màu dung dịch KMnO4 ở nhiệt độ thường là stiren.
- Với 2 hỗn hợp phản ứng còn lại ta đem đun nóng, chất nào làm mất màu dung dịch KMnO4 (nóng) thì là toluen, còn lại là benzen.

- C và Si đều thể hiện tính khử hoặc tính oxi hóa trong các phản ứng hóa học
+ Đều có tính oxi hóa: ( tác dụng được với một số kim loại)
\(C+Mg\underrightarrow{^{to}}Mg_2C\\ Si+Mg\underrightarrow{^{to}}Mg_2Si\)
+ Đều có tính khử : ( tác dụng với một số phi kim)
\(C+O_2\underrightarrow{to}CO_2\\
Si+O_2\underrightarrow{to}SiO_2\)
- Khác nhau:
+ Si tác dụng mạnh được với dung dịch kiềm giải phóng khí H2 còn C thì không:
\(Si+2NaOH+H_2O\rightarrow Na_2SiO_3+2H_2\uparrow\)
+ C khử được một số oxit kim loại còn Si thì không khử được:
\(C+2FeO\underrightarrow{^{to}}2Fe+CO_2\uparrow\)

- Những tính chất khác biệt:
+ Với axit H2SO4 loãng có tính axit, còn H2SO4 đặc mới có tính oxi hoá mạnh, còn axit HNO3 dù là axit đặc hay loãng đề có tính oxi hoá mạnh khi tác dụng với các chất có tính khử.
+ H2SO4 loãng không tác dụng được với các kim loại đứng sau hiđro trong dãy hoạt động hoá học như axit HNO3.
Fe + H2SO4 (loãng) → FeSO4 + H2↑
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
- Những tính chất chung:
∗ Với axit H2SO4 loãng và HNO3 đều có tính axit mạnh
+ Thí dụ:
Đổi màu chất chỉ thị: Quỳ tím chuyển thành màu hồng
Tác dụng với bazơ, oxit bazơ không có tính khử (các nguyên tố có số oxi hoá cao nhất):
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3+ 6H2O
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2↑
H2SO4 + Na2SO3 → Na2SO4 + H2O + SO2↑
∗ Với axit H2SO4(đặc) và axit HNO3 đều có tính oxi hoá mạnh
+ Thí dụ:
Tác dụng được với hầu hết các kim loại (kể cả kim loại đứng sau hiđro trong dãy hoạt động hoá học) và đưa kim loại lên số oxi hoá cao nhất.
Fe + 4HNO3 → Fe(NO3)3 + NO↑ + 2H2O
Cu + 2H2SO4(đặc) → CuSO4 + SO2↑ + 2H2O
Tác dụng với một số phi kim (đưa phi kim lên số oxi hoá cao nhất)
C + 2H2SO4(đặc) → CO2↑ + 2SO2↑ + 2H2O
S + 2HNO3 → H2SO4 + 2NO↑
Tác dụng với hợp chất( có tính khử)
3FeO + 10HNO3 → 3Fe(NO3)3 + NO↑ + 5H2O
2FeO + 4H2SO4(đặc) → Fe2(SO4)3 + SO2↑ + 4H2O
Cả hai axit khi làm đặc nguội đều làm Fe và Al bị thụ động hoá (có thể dùng bình làm bằng nhôm và sắt để đựng axit nitric và axit sunfuaric đặc)

∗ So sánh tính chất hóa học anken và ankin:
- Giống nhau :
+ Cộng hiđro.
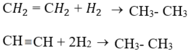
+ Cộng brom (dung dịch).
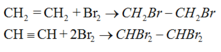
+ Cộng HX theo quy tắc Mac-côp-nhi-côp.
+ Làm mất màu dung dịch KMnO4.
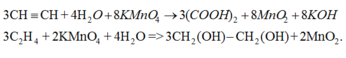
- Khác nhau :
+ Anken : Không có phản ứng thế bằng ion kim loại.
+ Ankin : Ank-1-in có phản ứng thế bằng ion kim loại.
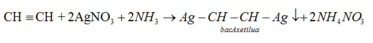

∗ So sánh tính chất hóa học ankan và ankybenzen:
- Giống nhau:
+ Phản ứng thế (halogen):
CH4 + Cl2 → CH3Cl + HCl
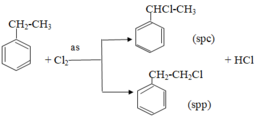
+ Phản ứng oxi hóa:
CH4 + 2O2 → CO2 +2H2O
C7H8 + 8O2 → 7CO2 + 4H2O
- Khác nhau:
+ Ankan: có phản ứng tách
C2H6 -500oC, xt→ CH2 = CH2 + H2
+ Ankylbenzen: có phản ứng cộng
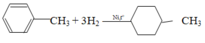

- Những tính chất chung: Đều có tính axit
+ Chuyển màu chất chỉ thị: Quỳ tím chuyển thành màu hồng
+ Tác dụng với bazơ, oxit bazơ không có tính khử (các nguyên tố có số oxi hoá cao nhất):
3NaOH + H3PO4 → Na3PO4 + 3H2O
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
+ Tác dụng với một số muối của axit yếu và không có tính khử:
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2↑
2H3PO4 + 3Na2SO3 → 2Na3PO4 + 3H2O + 3SO2↑
- Những tính chất khác nhau:
| HNO3 | H3PO4 |
| - Axit HNO3 là axit mạnh HNO3 → H+ + NO3- - Axit HNO3 có tính oxi hoá mạnh Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O S + 2HNO3 → H2SO4 + 2NO 3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O |
- Axit H3PO4 là một triaxit trung bình H3PO4 ⇆ H+ + H2PO4- H2PO4- ⇆ H+ + HPO42- HPO42- ⇆ H+ + PO43- - Axit H3PO4 không có tính oxi hoá. 3Fe + 2H3PO4 → Fe3(PO4)2 + 3H2 S + H3PO4 → không phản ứng 3FeO +2H3PO4 → Fe3(PO4)2 + 3H2O |

– Cho các chất lần lượt tác dụng với dung dịch Br2, chất nào làm nhạt màu dung dịch Br2 thì đó là hex-1-en.
- Cho 2 chất còn lại qua dung dịch KMnO4, chất nào làm mất màu dung dịch KMnO4 thì đó là toluen.
PTHH:

CH3CH2CH2OH \(\underrightarrow{H_2SO_{4đ}}\) CH3CH=CH2 + H2O
CH3CH(OH)CH3 \(\underrightarrow{H_2SO_{4đ}}\) CH3CH=CH2 + H2O
=> alkene sinh ra khi đun propan-1-ol và propan-2-ol với dung dịch sulfuric acid đặc ở nhiệt độ thích hợp đều là CH3CH=CH2.
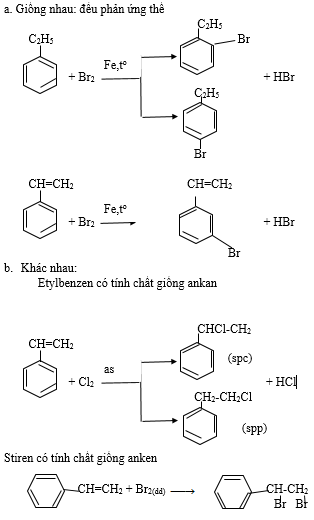
a. Giống nhau: đều phản ứng thế
b. Khác nhau:
Etylbenzen có tính chất giống ankan
Stiren có tính chất giống anken