

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Để phân biệt 5 dung dịch NaCl, NaBr, NaI , NaOH , HCl đựng trong 5 lọ bị mất nhãn có thể dùng trực tiếp thuốc thử nào.
a. Phenolphtalein , khí Cl2
b. Dung dịch AgNO3 , dung dịch CuCl2
c. Quỳ tím , khí Cl2
d. Phenolphtalein , dung dịch AgNO3

1.
a)
- Cho quỳ tím vào các dung dịch
Quỳ tím chuyển thành màu đỏ : HCl , HNO3 (nhóm 1 )
Quỳ tím chuyển thành màu xanh : KOH , Ba(OH)2 ( nhóm 2 )
Quỳ tím không xảy ra hiện tượng : NaCl và NaNO3 (nhóm 3 )
*Cho AgNO3 vào ( nhóm 1 ) ta được :
Kết tủa trắng : HCl
\(AgNO3+HCl\rightarrow AgCl\downarrow+HNO3\)
Không xảy ra hiện tượng : HNO3
*Cho AgNO3 vào (nhóm 3) ta được :
Kết tủa trắng : NaCl
\(NaCl+AgNO_3\rightarrow NaNO_3+AgCl\downarrow\)
Không xảy ra hiện tượng :NaNO3
*Cho H2SO4 vào ( nhóm 2) ta được :
Kết tủa trắng : Ba(OH)2
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4\downarrow+2H_2O\)
Không xảy ra hiện tượng : KOH
b)
- Cho quỳ tím vào các dung dịch
Quỳ tím chuyển thành màu đỏ : HCl , H2SO4 (nhóm 1)
Quỳ tìm chuyển thành màu xanh : NaOH
Không xảy ra hiện tượng :NaCl , NaBr ; NaI (nhóm 2)
*Cho AgNO3 vào (nhóm 1) ta được
Kết tủa trắng HCl
\(AgNO_3+HCl\rightarrow AgCl\downarrow+HNO_3\)
Không xảy ra hiện tượng H2SO4
Cho AgNO3 vào (nhóm 3) ta được
Kết tủa trắng là : NaCl
\(NaCl+AgNO_3\rightarrow AgCl\downarrow+NaNO_3\)
Chuyển thành màu vàng nhạt là :NaBr
\(AgNO3+NaBr\rightarrow AgBr\downarrow+NaNO_3\)
Chuyển thành màu vàng : NaI
\(AgNO_3+NaI\rightarrow AgI\downarrow+NaNO_3\)
2.
Cho hỗn hợp X vào HCl chỉ có Fe phản ứng:
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: \(n_{H2}=\frac{0,448}{22,4}=0,02\left(mol\right)=n_{Fe}\)
Cho X tác dụng với Cl2
\(2Fe+3Cl_2\rightarrow2FeCl_3\)
\(Cu+Cl_2\rightarrow CuCl_2\)
\(\rightarrow n_{FeCl3}=n_{Fe}=0,02\left(mol\right)\)
\(\rightarrow m_{FeCl3}=0,02.\left(56+35,5.3\right)=3,25\left(g\right)\)
\(m_{CuCl2}=7,3-3,25=4,05\left(g\right)\)
\(\rightarrow n_{CuCl2}=\frac{4,05}{64+35,5.2}=0,03\left(mol\right)=n_{Cu}\)
\(\rightarrow m=m_{Fe}+m_{Cu}=0,02.56+0,03.64=3,04\left(g\right)\)
3.
Gọi số mol Al là x; Fe là y
\(\rightarrow27x+56y=8,3\left(g\right)\)
\(Al+3HCl\rightarrow AlCl_3+\frac{3}{2}H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(\rightarrow n_{H2}=1,5n_{Al}+n_{Fe}=1,5x+y=\frac{5,6}{22,4}=0,25\left(mol\right)\)
Giải được \(x=y=0,1\)
\(\rightarrow m_{Al}=0,1.27=2,7\left(g\right)\)
\(\rightarrow\%m_{Al}=\frac{2,7}{8,3}=32,5\%\rightarrow\%m_{Fe}=100\%-32,5\%=67,5\%\)
Ta có muôí gồm AlCl3 và FeCl2
\(\rightarrow m_{muoi}=0,1.\left(27+35,5.3\right)+0,1.\left(56+35,5.2\right)=20,05\left(g\right)\)
b) Ta có: nHCl phản ứng=2nH2=0,5 mol
\(n_{HCl_{tham.gia}}=0,5.120\%=0,6\left(mol\right)\)
\(\rightarrow V_{HCl}=\frac{0,6}{1}=0,6\left(l\right)\)

Đáp án B.
- Dùng BaCl2 nhận ra H2SO4 nhờ hiện tượng kết tủa trắng.
- Dùng H2SO4 vừa nhận ra cho vào hai ống nghiệm đựng hai chất còn lại.
+ Có kết tủa trắng → Ba(OH)2
+ Không hiện tượng → HCl.
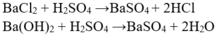

Câu 2 Bằng phương pháp hóa học hãy phân biệt các lọ mất nhãn đựng các loại hóa chất sau: NaNO3, HCl , NaCl , HNO3
NHÚM quỳ tím vào từng mẫu thử
có 2 mẫu làm quỳ tím chuyển đỏ HNO3,HCl (1)
có 2 mẫu ko làm chuyển màu là NaNO3,NaCl (2)
SAU ĐÓ CHO AgNO3 VÀO MẪU THỬ
MẪU THỬ (1) CÓ KẾT TỦA LÀ HCl
HCl+AgNO3--->HNO3+AgCl
mẫu còn lại là HNO3
MẪU THỬ 2 CÓ KẾT TỦA LÀ NaCl
NaCl+AgNO3-->AgCl+NaNO3
mẫu còn lại là NaNO3

Đáp án B
Lời giải
Dùng dung dịch BaCl2 để phân biệt các dung dịch : H2SO4 loãng, Ba(OH)2 và HCl
|
|
H2SO4 loãng |
Ba(OH)2 |
KCl |
| Dung dịch BaCl2 |
Kết tủa trắng |
Không hiện tượng |
Không hiện tượng |
| Dung dịch H2SO4 |
|
Kết tủa trắng |
Không hiện tượng |
Đầu tiên dùng dung dịch BaCl2 sẽ nhận biết được H2SO4 loãng:
![]()
Dùng dung dịch H2SO4 vừa nhận biết được để nhận biết các dung dịch Ba(OH)2 và HCl:
![]()

a,
Dung dịch CuCl2 màu xanh.
Cô cạn 3 dd còn lại. Chỉ HCl cô cạn ko có cặn, còn lại có cặn.
Nhỏ CuCl2 vào 2 dd còn lại. KOH có kết tủa xanh lơ, ZnCl2 thì không.
\(ZnCl_2+2KOH\rightarrow Zn\left(OH\right)_2+2KCl\)
b,
Dung dịch Cu(NO3)2 màu xanh.
Cô cạn 3 dd còn lại. Chỉ HCl cô cạn ko có cặn, còn lại có cặn.
Nhỏ Cu(NO3)2 vào 2 dd còn lại. NaOH có kết tủa xanh lơ, AlCl3 thì không.
\(Cu\left(NO_3\right)_2+2NaOH\rightarrow Cu\left(OH\right)_2+2NaNO_3\)
c,
Dung dịch CuSO4 màu xanh.
Nhỏ CuSO4 vào 3 dd còn lại. KOH kết tủa xanh lơ. AgNO3 kết tủa trắng. KCl ko hiện tượng.
\(CuSO_4+2KOH\rightarrow Cu\left(OH\right)_2+K_2SO_4\)
\(2AgNO_3+CuSO_4\rightarrow Cu\left(NO_3\right)_2+Ag_2SO_4\)