Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Số mol CaCO3 là nCaCO3 = 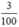 =0,03(mol)
=0,03(mol)
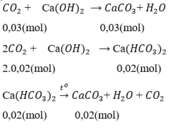
Số mol kết tủa thêm nCaCO3 = 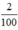 = 0,02 (mol)
= 0,02 (mol)
Theo pt ⇒ nCa(HCO3)2 = nCaCO3 = 0,02 mol
Tổng số mol CO2 = nCO2 (1) + nCO2 (2) = 0,03 + 2. 0,02 = 0,07 (mol)

Đáp án C
Theo giả thiết, suy ra : Khi cho V lít CO 2 vào dung dịch chứa 0,42 mol Ca ( OH ) 2 thì chưa có hiện tượng hòa tan kết tủa. Sau khi lọc bỏ kết tủa thêm tiếp 0,6V lít CO 2 vào thì đã có hiện tượng hòa tan một phần kết tủa (nếu không có hiện tượng hòa tan kết tủa thì lượng kết tủa thu được phải là 0,6a gam).
Xét toàn bộ quá trình phản ứng, ta có :
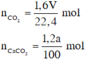
Kết quả thí nghiệm được biểu diễn bằng đồ thị sau :
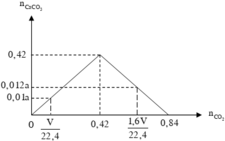
Từ đồ thị, suy ra :
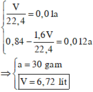

\(\left\{{}\begin{matrix}Al:a\\Fe3O4:0,06\\FeO:0,04\\Fe2O3:0,05\end{matrix}\right.\) suy ra chất rắn Y gồm Al, Fe, Al2O3, Fe3O4, FeO,Fe2O3
Khi cho Y vào dung dịch NaOH dư khuấy đều thu được 9,36 g kết tủa
=> n Al(OH)3= 0,12 => a=0,12
Dùng nhiệm vụ H+:
2HCl + O-2 -> H2O + 2 Cl-
0,43-----------> 0,86
2HCl + 2e -> H2 + 2 Cl-
0,1 -------> 0,2
=> n HCl dư = 1,26-0,86-0,2 =0,2
=> dd Z
dung dịch Z \(\left\{{}\begin{matrix}Al3+:0,12\\Fe2+:a,Fe3+0,32-a\\H+:0,2\\Cl-1,26\end{matrix}\right.\) suy ra a=0,26
FeCl2 =0,26
3Fe2+ + 4H+ + NO3- -> 3Fe3+ + NO + 2 H2O
0,15<----0,2
=> n FeCl2 dư = 0,11
3AgNO3 + FeCl2 -> 2 AgCl + Ag + Fe(NO3)3
0,11------------------> 0,11
=> m kt= m Ag + mAgCl = 0,11 .108+ 1,26 ( 108+ 35,5)= 192,6 (g)
đáp án C

m H2O + m CO2 = 18,6
n CO2 = 2.0,2 - 0,1 = 0,3 mol
=> n H2O = 0,3 mol
n O = (9 - 12.0,3 - 2.0,3)/16 = 0,3
=> X có dạng (CH2O)n
đủ để ra B rồi đó.
còn không n Ag = 0,02 => n X = 0,01
=> M X = 180
=> C6H12O6

Chọn D
Từ thông tin đề cho ta có thể tìm được số mol của CO2. Để tìm được mol O2 tham gia phản ứng đốt cháy hỗn hợp X thì cần tìm số mol H trong X tham gia phản ứng cháy. Nhưng số H trong X của các hợp chất lại rất khác nhau. Khó quá !Làm thế nào đây ?
Ta thử làm như sau :
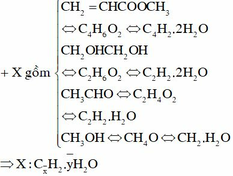
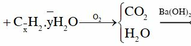
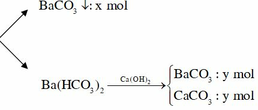


Chọn A
Hỗn hợp gồm: C4H6O2; C2H6O2; C2H4O và CH4O.
Quan sát: 2 thằng đầu cùng H6O2; 2 thằng sau cùng H4O.
Yêu cầu liên quan đến O2 cần đốt ||→ tách bỏ H2O lại thấy sự đặc biệt:
0,15 mol hỗn hợp gồm x mol C + y mol H2O + 0,15 mol H2.
Chuyển qua bài tập CO2 + dung dịch kiềm: vì Ca(OH)2 vào có thêm kết tủa
||→ CO2 + 0,2 mol Ba(OH)2 → BaCO3↓ + Ba(HCO3)2 1.
Theo đó: Ca(OH)2 + Ba(HCO3)2 → CaCO3 + BaCO3 + 2H2O 2;
mtủa (2) = 18 gam ||→ có 0,18 mol Ca(HCO3)2 và 0,18 mol BaCO3. Bảo toàn Ba → nBaCO3 ở 1 = 0,02 mol.
||→ x = ∑nCO2 = 0,02 + 0,18 × 2 = 0,38 mol (theo bảo toàn C ở 1.
Ta có: a = ∑nO2 cần đốt = x + ½.nH2 = 0,38 + 0,15 ÷ 2 = 0,455 mol


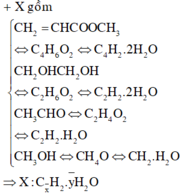
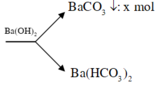



Số mol CaCO3 là nCaCO3 =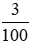 =0,03(mol)
=0,03(mol)
Số mol kết tủa thêm nCaCO3 =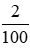 = 0,02 (mol)
= 0,02 (mol)
Theo pt ⇒ nCa(HCO3)2 = nCaCO3 = 0,02 mol
Tổng số mol CO2 = nCO2 (1) + nCO2 (2) = 0,03 + 2. 0,02 = 0,07 (mol)
Chọn C