Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
Giả sử lấy lượng mỗi chất là a gam.
MnO2 + 4HCl \(\rightarrow\) MnCl2 + Cl2 + 2H2O (1)
2KMnO4 + 14 HCl \(\rightarrow\)2MnCl2 + 2KCl + 5Cl2 + 8H2O (2)
K2Cr2O7 + 14 HCl \(\rightarrow\)2CrCl2 + 2KCl + 3Cl2 + 7H2O (3)
Vậy dùng : KMnO4 điều chế được nhiều Cl2 hơn
b) Nếu số mol các chất bằng n mol
Theo (1) nmol MnO2 \(\rightarrow\) nmol Cl2
Theo (2) nmol KMnO4 \(\rightarrow\) 2,5 nmol Cl2
Theo (3) nmol K2Cr2O7 \(\rightarrow\) 3nmol Cl2
Ta có: 3n > 2,5n > n
Vậy dùng K2Cr2O7 được nhiều hơn Cl2 hơn
Clo oxi hóa dễ dàng Br – tronh dung dịch muối bromua và I- trong dung dịch muối iotua.
Cl2 + 2NaBr \(\rightarrow\) 2NaCl + Br2
Cl2 + 2NaI \(\rightarrow\) 2NaCl + I2

a/
\(2HCl\underrightarrow{^{đpdd}}H_2+Cl_2\)
\(3Cl_2+2Fe\underrightarrow{^{to}}2FeCl_3\)
\(FeCl_3+3NaOH\rightarrow3NaCl+Fe\left(OH\right)_3\)
\(2NaCl+H_2SO_4\underrightarrow{^{to}}Na_2SO_4+2HCl\)
\(HCl+CuO\rightarrow CuCl_2+H_2O\)
\(CuCl_2+AgNO_3\rightarrow AgCl+Cu\left(NO_3\right)2\)
b/
\(2HCl\underrightarrow{^{đpdd}}H_2+Cl_2\)
\(Cl_2+2Na\underrightarrow{^{to}}2NaCl\)
\(2NaCl+H_2SO_{4_{dac}}\underrightarrow{^{to}}Na_2SO_4+2HCl\)
\(2HCl+Fe\rightarrow FeCl_2+H_2\)
c/
\(MnO_2+4HCl_đ\underrightarrow{^{to}}MnO_2+Cl_2+2H_2O\)
\(Cl_2+2K\underrightarrow{^{to}}2KCl\)
\(2KCl+H_2SO_4\underrightarrow{^{to}}K_2SO_4+2HCl\)
\(2HCl\underrightarrow{^{đpdd}}H_2+Cl_2\)
\(Cl_2+2NaBr\rightarrow2NaCl+Br_2\)
\(Br_2+2NaI\rightarrow NaBr+I_2\)
d/
\(2KMnO_4+16HCl_đ\underrightarrow{^{to}}2KCl+2MnCl_2+5Cl_2+8H_2O\)
\(Cl_2+H_2\underrightarrow{^{as}}2HCl\)
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
\(FeCl_3+3AgNO_3\rightarrow3AgCl+Fe\left(NO_3\right)_3\)

\(Br_2+2KOH\rightarrow KBr+KBrO+H_2O\)
\(3Br_2+6KOH\rightarrow5KBr+KBrO+3H_2O\)
Tương tự cho NaOH và Ca(OH)2
\(Br_2+2NaI\rightarrow2NaBr+I_2\)
\(Br_2+2KI\rightarrow2KBr+I_2\)
\(Cl_2+2NaOH\rightarrow KBr+KBrO+H_2O\)
\(3Cl_2+6KOH\rightarrow5KCl+KClO+3H_2O\)
Tương tự cho NaOH và Ca(OH)2
\(Cl_2+2KBr\rightarrow2KCl+Br_2\)
Tương tự cho NaBr, NaI, KI, MgBr2, CaBr2, BaBr2
\(I_2+2KOH\rightarrow KI+KIO+H_2O\)
\(3I_2+6KOH\rightarrow5KI+KIO_3+3H_2O\)
Tương tự cho NaOH và Ca(OH)2
I2 + NaOH ở điều kiện thường hay nhiệt độ thì sản phẩm luôn là muối IO3- nha em

a) (1) MnO2 + 4 HCl(đặc) -to-> MnCl2 + Cl2 + 2 H2O
(2) Cl2 + H2 \(\Leftrightarrow\) 2 HCl
(3) HCl + NaOH -> NaCl + H2O
(4) 2 NaCl + 2 H2O -đpddcmnx-> 2 NaOH + H2 + Cl2
(5) Cl2 + 2 H2O + SO2 -> H2SO4 + 2 HCl
(6) H2SO4 + BaCl2 -> BaSO4 + 2 HCl
b)
(1) BaCl2 -điện phân nóng chảy nhiệt độ cao-> Ba + Cl2
(2) Cl2 + H2 \(\Leftrightarrow\) 2 HCl
(3) Fe + 2 HCl -> FeCl2 + H2
(4) 2 FeCl2 + Cl2 -to-> 2 FeCl3
(5) 2 FeCl3 + 3 Ba(OH)2 -> 2 Fe(OH)3 +3 BaCl2
(6) BaCl2 + H2SO4 -> BaSO4 + 2 HCl
c) (1) BaCl2 + H2SO4 -> BaSO4 +2 HCl
(2) 2 HCl + CuO -> CuCl2 + H2O
(3) CuCl2 + 2 KOH -> Cu(OH)2 + 2 KCl
(4) KCl + H2O -đpddcmnx-> KOH + 1/2 Cl2 + 1/2 H2
(5) 6 KOH + 3 Cl2 -to->5 KCl + KClO3 +3 H2O
(6) 2 KClO3 -to-> 2 KCl + 3 O2
a)
(1) MnO2 + 4HCl(đ) -to-> MnCl2 + Cl2 + 2H2O
(2) Cl2 + H2 <-as-> 2 HCl
(3) HCl + NaOH => NaCl + H2O
(4) 2NaCl + 2H2O -đpddcmn-> 2NaOH + H2 + Cl2
(5) Cl2 + 2H2O + SO2 => H2SO4 + 2HCl
(6) H2SO4 + BaCl2 => BaSO4 + 2HCl
b)
(1) BaCl2 -đpdd-> Ba + Cl2
(2) Cl2 + H2 ⇔ 2HCl (Đk : ánh sáng hoặc nhiệt độ)
(3) Fe + 2HCl => FeCl2 + H2
(4) 2FeCl2 + Cl2 -to-> 2FeCl3
(5) 2FeCl3 + 4Ba(OH)2 => 2Fe(OH)3 + 3BaCl2
(6) BaCl2 + H2SO4 => BaSO4 + 2HCl
c)
(1) BaCl2 + H2SO4 => BaSO4 +2HCl
(2) 2HCl + CuO => CuCl2 + H2O
(3) CuCl2 + 2KOH => Cu(OH)2 + 2KCl
(4) 2KCl + 2H2O -đpddcmn-> 2KOH + Cl2 + H2
(5) 6KOH + 3Cl2 -to-> 5KCl + KClO3 +3H2O
(6) 2KClO3 -to-> 2KCl + 3O2

Gọi chung Cl2 và Br2 là X2, 2 bazo là ROH
X2 + 3ROH → 2RX + RXO3 + 3H2O
X2 + 2ROH→ RX + RXO + H2O
nROH = 0.5 mol
nX2 = 0.25 mol
→ Phản ứng xảy ra là phản ứng 2 (nROH = 2nX2)
Cl2 phản ứng trước Br2
X2 + 2ROH→ RX + RXO + H2O
→ Cl2 + 2ROH → NaCl + NaClO + H2O
----0.1-----0.2--------0.1
mH2O = 0.1 x 18 = 1.8g
nROH = 0,5 → mROH = 24.8g (0.2 NaOH, 0.3 KOH)
→ nROH = 0,2 → mROH = 9.92g
[m] mRCl = mCl2 + mROH p/ứ - mH2O
= 7.1 + 9.92 - 1.8 = 15,22.
1.
nCl2 = \(\frac{0,896}{22,4}\) = 0,04 (mol) , nNaOH = 1.0,2 = 0,2 (mol)
............Cl2 + 2NaOH → NaCl + NaClO + H2
Đầu.. 0,04........0,2
Pư .......0,04.......0,08............0,04.........0,04.........0,04
Spư......0............0,16............0,04.........0,04.........0,04
CM NaCl = \(\frac{0,04}{0,2}=0,2M\)
CM NaClO = CM NaCl = 0,2 M
CM NaOH = \(\frac{0,12}{0,2}=0,6M\)

Những phản ứng sau là phản ứng oxi hóa khử:
.jpg)
.png)
Cl2 vừa là chất khử vừa là chất oxi hóa.
b) .png) + 2HCl \(\rightarrow\) CaCl2 + Cl2 + H2O
+ 2HCl \(\rightarrow\) CaCl2 + Cl2 + H2O
CaOCl2: phân tử tự oxi hóa khử, HCl đóng vai trò môi trường
.jpg)
.png) Cl2 vừa là chất oxi hóa, vừa là chất khử.
Cl2 vừa là chất oxi hóa, vừa là chất khử.
.jpg)
.png)
HCl là chất khử, KClO3 là chất oxi hóa
.jpg)

CaOCl2: phân tử tự oxi hóa
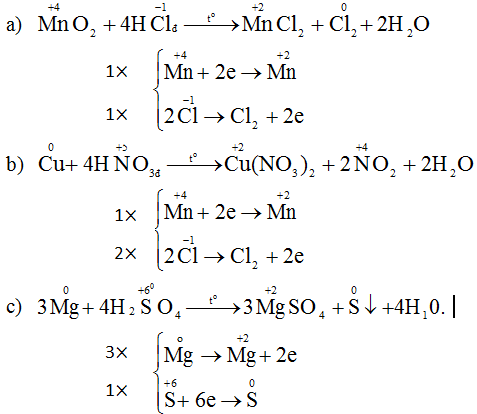
Phương trình hóa học của phản ứng:
Cl2 + 2NaI → 2NaCl + I2
71g (2 x 127)g
X g 12,7g
X = 3,55g
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
(4 x 36,5g) 71g
Y g 3,55 g
Y = 7,3g
Khối lượng HCl cần dùng là 7,3g