Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án B.
13,12 gam E + 0,2 mol KOH (vừa đủ) → … -COOK + … nên ∑nO trong E = 0,4 mol.
Giải đốt 13,12 gam E (gồm C, H, O) cần 0,5 mol O2 thu được x mol CO2 + y mol H2O.
12x + 2y +0,4x16 = 13,12
2x+y = 0,4 + 0,5x2
→x = 0,49; y = 0,42
Mặt khác, 0,36 mol E phản ứng vừa đủ với 0,1 mol Br2 và kết hợp giả thiết “chữ” về X, Y.
→ trong hai axit X và Y thì có một axit no và một axit không no, có đúng một nối đôi C=C.
Phản ứng tạo este: 1X + 1Y + 1C2H4(OH)2 → 1Z + 2H2O.
→ Quy đổi E: axit – este về a mol CnH2nO2 + b mol CmH2m-2O2 +c mol 1C2H4(OH)2 – 2c mol H2O.
Ta có tương quan đốt có: ∑nCO2 - ∑nH2O = b + 2c c = b +c = 0,49 -0,42 = 0,07 mol (1).
Bảo toàn nguyên tố oxi có: 2a + 2b =0,4 mol → a + b = 0,2 mol (2).
giả sử tỉ lệ 0,36 mol E so với 13,12 gam E là k, ta có: nE = ka + kb + kc -2kc = 0,36 mol.
Chỉ có kb mol CmH2m-2O2 phản ứng với Br2 → kb = 0,1 mol.
Theo đó, rút gọn k có phương trình: a + b –c =3,6b ↔ 0,2 – c =3,6b (3).
Giải hệ (1), (2), (3) được a = 0,15 mol; b = 0,05 mol; c = 0,02 mol.
Thay lại, có số mol CO2 : 0,15n + 0,05m + 0,02x2 = 0,49↔ 3n + m = 9
Với điều kiện n, m nguyên và yêu cầu n≥1; m≥3→ cặp (n;m) = (2;3) duy nhất thỏa mãn.
Vậy hỗn hợp F gồm 0,15 mol CH3COOK (muối A) và 0,05 mol C2H3COOK (muối B).
→ Tỉ lệ cần tìm a:b = 0,15x98: (0,05x110) ≈ 2,67

Đáp án A
· 13,12 gam E + 0,2 mol KOH (vừa đủ) ® ...-COOK + ... nên ∑nO trong E = 0,4 mol.
Giải đốt 13,12 gam E (gồm C, H, O) cần 0,5 mol O2 thu được x mol CO2 + y mol H2O.
12x + 12y +0,4x16 = 13,12
2x + y = 0,4 +0,5x2
→x = 049; y= 0,42
· Mặt khác, 0,36 mol E phản ứng vừa đủ với 0,1 mol Br2 và kết hợp giả thiết “chữ” về X, Y.
® trong hai axit X va Y thì có một axit no và một axit không no, có đúng một nối đôi C=C.
Phản ứng tạo este: 1X + 1Y + 1C2H4(OH)2 ® 1Z + 2H2O.
® Quy đổi E: axit – este về a mol CnH2nO2 + b mol CmH2m – 2O2 + c mol C2H4(OH)2 – 2c mol H2O.
Ta có tương quan đốt có: ∑nCO2 -∑nH2O = b+ 2c –c =b +c = 0,49-0,42 = 0,07 mol
Bảo toàn nguyên tố oxit có: 2a + 2b = 0,4 mol ® a + b = 0,2 mol (2).
· Giả sử tỉ lệ 0,36 mol E so với 13, 12 gam E là k, ta có: nE = ka + kb + kc – 2kc = 0,36 mol.
Chỉ có kb mol CmH2m – 2O2 phản ứng với Br2 ® kb = 0,1 mol.
Theo đó, rút gọn k có phương trình: a + b – c = 3,6b Û 0,2 – c = 3,6b (3).
Giải hệ (1), (2), (3) được a = 0,15 mol; b = 0,05 mol; c = 0,02 mol.
Thay lại, có số mol CO2: 0,15n + 0,05 + 0,02x2 = 0,49 ↔ 3n+m = 9
Với điều kiện n, m nguyên và yêu cầu n≥1; m≥3 ® cặp (n;m) = (2;3) duy nhất thỏa mãn.
Vậy hỗn hợp F gồm 0,15 mol CH3COOK (muối A) và 0,05 mol C2H3COOK (muối B).
® Tỉ lệ cần tìm a:b = 0,15x98 : (0,05x110) ≈2,67

Đáp án B
gt ⇒ X không thể là HCOOH.
Quy E về CH3COOH, (CH3COO)2C2H4, CH2 và H2.
với số mol là x, y, z và t
mE = 60x + 146y + 14z + 2t = 13,12(g);
nO2 = 2x + 6,5y + 1,5z + 0,5t = 0,5 mol.
nKOH = x + 2y = 0,2 mol

⇒ giải hệ có: x = 0,16 mol; y = 0,02 mol; z = 0,05 mol; t = – 0,05 mol.
Muối gồm 0,2 mol CH3COOK; 0,05 mol CH2 và – 0,05 mol H2. Ghép CH2 và H2 kết hợp điều kiện ≤ 2π.
⇒ A là CH3COOK (0,15 mol) và B là CH2=CHCOOK (0,05 mol)
⇒ a : b = 2,672


→ C = 0,49: 0,18 = 2,72.
⇒ X là CH3COOOH:0,13 mol , Y là RCOOH: 0,03 mol , Z là CH3COOCH2-CH2OOCR: 0,02 mol

= 27 (CH2=CH–)
Vậy sau phản ứng thủy phân với KOH thu được ( 0,13+ 0,02) mol CH3COOK và ( 0,03 + 0,02) mol C2H3COOK
→ a : b = (0,15.98) : (0,05. 110) = 2,67


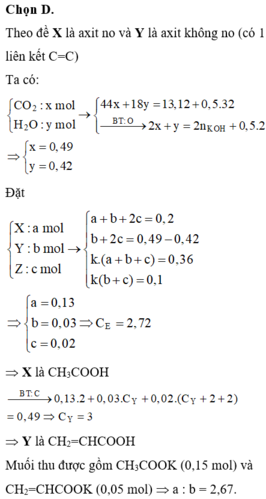

Đáp án D
Qúa trình 1:
Gọi a, b, c lần lượt là số mol X, Y, Z
Ta có: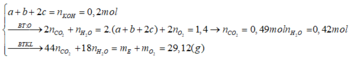
- Qúa trình 2: Khi cho E tác dụng với dd Br2, nhận thấy nBr2 = 0,1 < nE = 0,36
=> Trong X, Y chỉ có 1 chất tham gia phản ứng cộng Br2, khi đó Z được tạo bởi X,Y cũng có phản ứng cộng Br2.
+ Gọi X là chất có 2 liên kết pi => Y có chứa 1 liên kết pi và Z có chứa 3 liên kết pi
+ Ta có hệ sau:
(Với n, m là số C của X, Y với n≥ 3 và m ≥ 2)
+ Xét n =3 và m = 2. Từ đó Z gồm
B: CH2=CH- COONa : 0,05 mol và A: CH3- COONa : 0,15 mol => a/ b = 2,617
+ Nếu n > 3 và m < 2:Không thỏa mãn điều kiện