Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

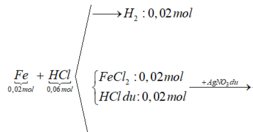
nFe = 1,12: 56 = 0,02 (mol); nHCl = 0,6 (mol)
Fe + 2HCl → FeCl2 + H2↑
0,02 → 0,04 → 0,02
Vậy dd X gồm FeCl2: 0,02 mol và HCl dư : 0,02 mol
Khi cho dd X + AgNO3 dư có phản ứng xảy ra:
Ag+ + Cl - → AgCl↓
0,06← 0,06 → 0,06 (mol)
3Fe2+ + NO3- + 4H+ → 3Fe3+ + NO↑ + 2H2O
0,015← 0,02
Fe2+ + Ag+ → Ag + Fe3+
(0,02- 0,015) → 0,05 (mol)
=> m↓ = mAgCl + mAg = 0,06. 143,5 + 0,005.108 = 9,15 (g)
Đáp án C

Đáp án A
nFe = 1,12 : 56 = 0,02 (mol) ; nHCl = 0,3.0,2 = 0,06(mol);
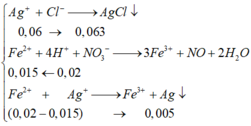
Chú ý:
Có phản ứng Ag + + Fe2+ → Fe3+ + Ag↓. Nếu các em không chú ý phản ứng này, mà chỉ tính mỗi kết tủa AgCl = 8,61 g => chọn ngay đáp án D sẽ dẫn tới sai lầm

Có Fe -> Fe2+
Cu -> Cu2+
Vì dư H+ và NO3 - thì Fe2+ -> Fe3+
(nhưng dạng bài kiểu này thì chắc chắn cho dư H+ và NO3- nên cứ cho Fe lên thẳng luôn )
nH+ = 0.4 mol
nNO3- = 0.08 mol
Fe + 4H+ + NO3- -> Fe3+ + NO + 2H2O
0.02--0.08---0.02
3Cu + 8H+ + 2NO3- -> 3Cu2+ + NO + 4H2O
0.03---0.08----0.02
nH+ dư = 0.4 -0.16= 0.24 mol
nNaOH(tối thiểu) = nH+ (trung hòa H+) + 3nFe3+ + 2nCu2+
= 0.24 + 0.02 nhân 3+ 0.03 nhân 2 = 0.36 mol
V tối thiểu = 360ml

nFe = 0,02 mol; nH+ = 0,06 mol ||⇒ X chứa 0,02 mol FeCl2 và 0,02 mol HCl.
● AgNO3 dư ⇒ Fe2+ → Fe3+ + e || 4H+ + NO3– + 3e → NO + 2HO; Ag+ + e → Ag.
Bảo toàn electron: nFe2+ = 3/4nH+ + nAg ⇒ nAg = 0,005 mol
Rắn gồm 0,06 mol AgCl và 0,005 mol Ag ⇒ m = 9,15(g)
Đáp án A

nFe = 0,02 mol; nH+ = 0,06 mol ||⇒ X chứa 0,02 mol FeCl2 và 0,02 mol HCl.
AgNO3 dư ⇒ Fe2+ → Fe3+ + e || 4H+ + NO3– + 3e → NO + 2HO; Ag+ + e → Ag.
Bảo toàn electron: nFe2+ = 3/4nH+ + nAg ⇒ nAg = 0,005 mol
Rắn gồm 0,06 mol AgCl và 0,005 mol Ag ⇒ m = 9,15(g)

A. 184,1 gam và 91,8 gam.
B. 84,9 gam và 91,8 gam.
C. 184,1 gam và 177,9 gam.
D. 84,9 gam và 86,1 gam.

Áp dụng định luật bảo toàn khối lượng ta có:
\(m=m_{ACl_n}+m_{BCl_m}=m_{A+B}+m_{HCl}-m_{H_2}\)
Áp dụng bảo toàn nguyên tố:
nHCl phản ứng = 2nH2 = 0,2 mol
Ta có m = 10 + 0,2 x 36,5 - 0,2 = 17,1 (g)
Chọn đáp án B

nFe = nFeCl3 = 0,06 mol => nO (oxit ) = ( 4 – 0,06.56)/16 = 0,04 mol
Quy đổi 4 gam A thành Fe và O. Cho tác dụng với HNO3 :
Fe à Fe3+ + 3e O + 2e à O2-
0,06 0,18 0,08 0,04
N+5 + 3e àNO => V = 0,1/3.22,4 = 0,747 lit
0,1 0,1/3
Đáp án C
nFe = 1,12: 56 = 0,02 (mol); nHCl = 0,6 (mol)
Fe + 2HCl → FeCl2 + H2↑
0,02 → 0,04 → 0,02
Vậy dd X gồm FeCl2: 0,02 mol và HCl dư : 0,02 mol
Khi cho dd X + AgNO3 dư có phản ứng xảy ra:
Ag+ + Cl - → AgCl↓
0,06← 0,06 → 0,06 (mol)
3Fe2+ + NO3- + 4H+ → 3Fe3+ + NO↑ + 2H2O
0,015← 0,02
Fe2+ + Ag+ → Ag + Fe3+
(0,02- 0,015) → 0,05 (mol)
=> m↓ = mAgCl + mAg = 0,06. 143,5 + 0,005.108 = 9,15 (g)
Chú ý:
Học sinh hay quên phương trình Fe2+ + Ag+ → Ag + Fe3+. Khi đó bỏ quên khối lượng của Ag sẽ chỉ có mAgCl = 8,61 (g) => chọn ngay Đáp án B sẽ dẫn đến sai lầm.