Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) 2KClO3 -> 2KCl + 3O2
b) MnO2 + 4HCl -> MnCl2 + Cl2 + 2H2O
b) SGK

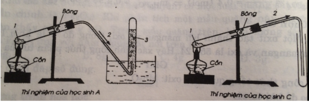
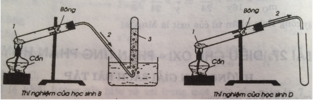
Học sinh A, C rap đúng
Học sinh B, D ráp thí nghiệm sai vì ống dẫn khí oxi không đi vào ống nghiêm làm cho khí oxi sẽ mất mát 1 ít.

Theo mình là đặt đứng bình. Vì CO2 nặng hơn không khí
\(d_{\dfrac{CO_2}{kk}}=\dfrac{44}{29}\approx1,52\)

- Phương pháp điều chế: cho các kim loại (Al, Mg, Fe, Zn,...) tác dụng với dd axit (HCl, H2SO4 loãng,...)
- Cách thu: ngửa bình
- Khác với cách thu oxi: Thu oxi thì phải úp bình

1/ Thí nghiệm 1: Điều chế clo. Tính tẩy màu của khí clo ẩm
6HCl + KClO3 --> KCl + 3Cl2 + 3H2O
Cl2 sinh ra sẽ tác dụng với nước làm cho dd tạo thành chứ HClO --> HCl + [O], chính [O] này sẽ làm mất màu tời giấy màu ban đầu
2/ Thí nghiệm 2: So sánh tính oxi hoá của clo, brom và iot
-- Dùng Clo, ở muối NaBr sẽ xuất hiện màu nâu đỏ của brôm mới tạo thành Cl2 + 2 NaBr --> 2NaCl + Br2. Ổ NaI sẽ có màu vàng nhạt xuất hiện của iod mới tạo thành, Cl2 + 2NaI --> 2NaCl + I2
- Dùng brôm chỉ thấy màu vàng của iod sinh ra Br2 + 2NaI --> 2NaBr + I2
- Dùng iod hok có hiện tượng
---> nhận xét tính oxi hoá giảm gần theo thứ tự Cl2 > Br2 > I2
3/ Thí nghiệm 3: Tác dụng của iot với hồ tinh bột
Cho vào ống nghiệm một ít hồ tinh bột. Nhỏ 1 giọt nước iot vào ống nghiệm. Quan sát hiện tượng và nêu nguyên nhân.
Hồ tinh bột sẽ hoá xanh do iod có tính khử, tạo phức được với tinh bột
4/ Thí nghiệm 4: Tính axit của HCl
- Lấy 4 ống nghiệm sạch. Bỏ vào 1 trong các ống 1 trong các chất rắn sau đây
+ 1 ít Cu(OH)2 màu xanh (Điều chế bằng cách nhỏ dung dịch NaOH vào dung dịch CuSO4 rồi gạn lấy kết tủa)
2NaOH + CuSO4 --> Cu(OH)2 + NaSO4
Cu(OH)2 + 2HCl --> CuCl2 + 2 H2O --> tủa sẽ tan dần
+ 1 ít bột CuO màu đen
CuO + 2HCl --> CuCl2 + H2O, chất rắn màu đen tan dần, tạo thành dd trong suốt
+ 1 ít bột CaCO3 màu trắng (hoặc một mẩu đá vôi)
CaCO3 + 2HCl --> CaCl2 + CO2 + H2O --> đá vôi tan dần, có khí thoát ra
+ 1 viên kẽm
Zn + 2HCl --> ZnCL2 + H2 --> viên kẽm tan và cho khí bay ra
5. Thí nghiệm 5: Tính tẩy màu của nước Gia-ven
Cho vào ống nghiệm khoảng 1 ml nước Gia-ven. Bỏ tiếp vào ống 1 vài miếng vải hoặc giấy màu. Để yên 1 thời gian. Quan sát hiện tượng. Nêu nguyên nhân
vải hoặc giấy màu sẽ mất màu dần do trong nước janven chứa NaClO. CHính chất này sẽ tạo thành NaCl + [O], với sự có mặt của [O] làm cho dd có tình tẩy rửa.
6. Thí nghiệm 6: Bài tập thực nghiệm phân biệt các dung dịch
Mỗi bình có chứa 1 trong các dung dịch NaBr, HCl, NaI, và NaCl (không ghi nhãn)
- Dùng quỳ tím, nhận ra HCl vì quỳ tím đổi sang màu đỏ, còn 3 muối NaCl, NaI, NaBr đều hok làm quỳ tìm đổi màu
- Dùng tiếp dd nước brôm, chất nào làm dd brom mất màu nâu đỏ và xuất hiện màu vàng là NaI. 2NaI + Br2 --> 2NaBr + I2
- Dùng tiếp dd nước Cl2, chất nào xuât hiện màu nâu đỏ là NaBr. 2NaBr + Cl2 --> 2NaCl + Br2
còn lại là NaCl

1. Tính khối lượng chất tham gia và sản phẩm
* Các bước giải:
- Đổi số liệu đầu bài. Tính số mol của chất mà đầu bài cho.
- Lập phương trình hoá học.
- Dựa vào số mol chất đã biết để tính số mol chất cần tìm.
2. Tính thể tích khí tham gia và tạo thành
H2+Cl2->2HCl
\(n_{H_2}=67,2:22,4=3\left(mol\right)\)
Ta có: \(n_{H_2}=n_{Cl_2}=3\left(mol\right)\)
\(V_{Cl_2}=3.22,4=67,2l\)
\(n_{HCl}=2n_{Cl_2}=2.3=6\left(mol\right)\)
\(m_{HCl}=6.36,5=219g\)

PTHH: 3Fe + \(2O_2\) --->\(Fe_3O_4\)
theo pt: 3_____2_____________1
theo đề: x______y_____________0.01
nFe3O4 là: 0.01mol
\Rightarrow nO2= 0.01*2/1=0.02 mol
VO2= 0.02*22.4=0.448l
b, PTHH : 2KMnO4 ----> K2MnO4 + MnO2 + O2
theo pt: 2__________1________1______1
theo đề: x___________________________0.02
=> n KMnO4= 0.02*2/1= 0.04 mol
=>mKMnO4= 0.04*158=6.32g
a. số mol của Fe3O4 là :
2.32 : 232 =0.01 mol
theo tỉ lệ mol ta có số mol của Fe là:
0.01 * 3 = 0.03 mol
khối lượng sắt là: 0.03*56=1.68g
số mol oxi là: 0.01*2=0.02mol
thể tích oxi là: 0.02*22.4= 0.448g
b. 2KMnO_4 ---> K2MnO4 + MnO2 + O2
---> nKMnO_4 = 2nO2 = 0,04 mol ---> mKMnO_4=0.04*158=6.32g
K M n O 4 K C l O 3 , H 2 O , H 2 O và ít tan trong nước, úp ngược miệng ống nghiệm vào trong nước.