Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a,PT: \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
Ta có: \(n_{CH_4}=\dfrac{3,2}{16}=0,2\left(mol\right)\)
Theo PT: \(n_{O_2}=2n_{CH_4}=0,4\left(mol\right)\)
\(\Rightarrow V_{O_2}0,4.22,4=8,96\left(l\right)\)
b, Theo PT: \(n_{CO_2}=n_{CH_4}=0,2\left(mol\right)\)
PT: \(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_{3\downarrow}+H_2O\)
Theo PT: \(n_{CaCO_3}=n_{CO_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{\downarrow}=m_{CaCO_3}=0,2.100=20\left(g\right)\)
Bạn tham khảo nhé!

\(n_{CH_4}=\dfrac{m_{CH_4}}{M_{CH_4}}=\dfrac{1,6}{16}=0,1mol\)
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\)
0,1 0,2 0,1 ( mol )
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\)
0,1 0,1 ( mol )
\(m_{CaCO_3}=n_{CaCO_3}.M_{CaCO_3}=0,1.100=10g\)
\(V_{O_2}=n_{O_2}.22,4=0,2.22,4=4,48l\)
\(V_{kk}=V_{O_2}.5=4,48.5=22,4l\)
nCH4 = 1,6/16 = 0,1 (mol)
PTHH: CH4 + 2O2 -> (t°) CO2 + 2H2O
Mol: 0,1 ---> 0,2 ---> 0,1
CO2 + Ca(OH)2 -> CaCO3 + H2O
Mol: 0,1 ---> 0,1 ---> 0,1
mCaCO3 = 0,1 . 100 = 10 (g)
Vkk = 0,2 . 5 . 22,4 = 22,4 (l)

a, \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_{3\downarrow}+H_2O\)
b, \(n_{CH_4}=\dfrac{3}{16}=0,1875\left(mol\right)\)
Theo PT: \(n_{CO_2}=n_{CH_4}=0,1875\left(mol\right)\Rightarrow m_{CO_2}=0,1875.44=8,25\left(g\right)\)
c, \(n_{CaCO_3}=n_{CO_2}=0,1875\left(mol\right)\Rightarrow m_{CaCO_3}=0,1875.100=18,75\left(g\right)\)

a, PT: \(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
Ta có: \(n_{C_2H_4}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Theo PT: \(n_{O_2}=3n_{C_2H_4}=0,75\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,75.2,24=16,8\left(l\right)\)
\(\Rightarrow V_{kk}=16,8.5=84\left(l\right)\)
b, Theo PT: \(n_{CO_2}=2n_{C_2H_4}=0,5\left(mol\right)\)
PT: \(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_{3\downarrow}+H_2O\)
Theo PT: \(n_{Ca\left(OH\right)_2}=n_{CaCO_3}=n_{CO_2}=0,5\left(mol\right)\)
\(\Rightarrow m_{\downarrow}=m_{CaCO_3}=0,5.100=50\left(g\right)\)
\(m_{Ca\left(OH\right)_2}=0,5.74=37\left(g\right)\)
\(\Rightarrow m_{ddCa\left(OH\right)_2}=\dfrac{37.100}{2}=1850\left(g\right)\)
Bạn tham khảo nhé!

Nhiệt phân hỗn hợp, ta có PTPƯ:
BaCO3 BaO + CO2
MgCO3 MgO + CO2
Al2O3 không
Chất rắn Khí D: CO2.
+ Hòa tan A vào H2O dư, ta có PTPƯ:
BaO + H2O Ba(OH)2
MgO + H2O không
Al2O3 + Ba(OH)2 Ba(AlO2)2 + H2O
Kết tủa
+ Khi cho dung dịch B tác dụng với CO2 dư:
Ba(AlO2)2 + 2CO2 + 4H2O 2Al(OH)3 + Ba(HCO3)2
+ Hòa tan C vào dung dịch NaOH dư, ta có PTPƯ:
MgO + NaOH không
Al2O3 + 2NaOH 2NaAlO2 + H2O
(Vì kết tủa C cho vào dung dịch NaOH dư có tan một phần chứng tỏ C có Al2O3 dư; phần không tan là MgO).

CH4+2O2-to>CO2+2H2O
0,05----0,1------0,05-----0,1 mol
n H2O=\(\dfrac{1,8}{18}\)=0,1 mol
=>VCH4=0,05.22,4=1,12l
=>Vkk=0,1.22,4.5=11,2l
c)
CO2+Ba(OH)2-->BaCO3+H2O
0,05--------------------0,05 mol
=>m BaCO3=0,05.197=9,85g
a) Số mol \(H_2O\) thu được là :
\(n_{H_2O}=1,8.18=0,1\left(mol\right)\)
Xét giai đoạn đốt cháy khí metan:
\(PTHH:CH_4+2O_2\rightarrow CO_2+2H_2O\left(1\right)\)
Sản phẩm cháy gồm \(CO_2\) và \(H_2O\). Hấp thụ sản phẩm cháy vào dung dịch \(Ba\left(OH\right)_2\) dư thì \(H_2O\) tan vào dung dịch và \(CO_2\) phản ứng với \(Ba\left(OH\right)_2\) theo phương trình sau:
\(CO_2+Ba\left(OH\right)_2\rightarrow BaCO_3\downarrow+H_2O\left(2\right)\)
\(0,05\rightarrow0,5\left(mol\right)\)
Theo \(\left(2\right)\)
\(\Rightarrow n_{BaCO_3}=0,05\left(mol\right)\)
b)
V=VCH4=0,05.22,4=1,12l
VO2=0,1.22,4=2,24l
vO2/vKK.100=20
⇒Vkk=10020.VO2=10020.2,24=11,2l.
c,Khối lượng kết tủa thu được là:
m↓=mBaCO3=197.0,05=9,85gam.
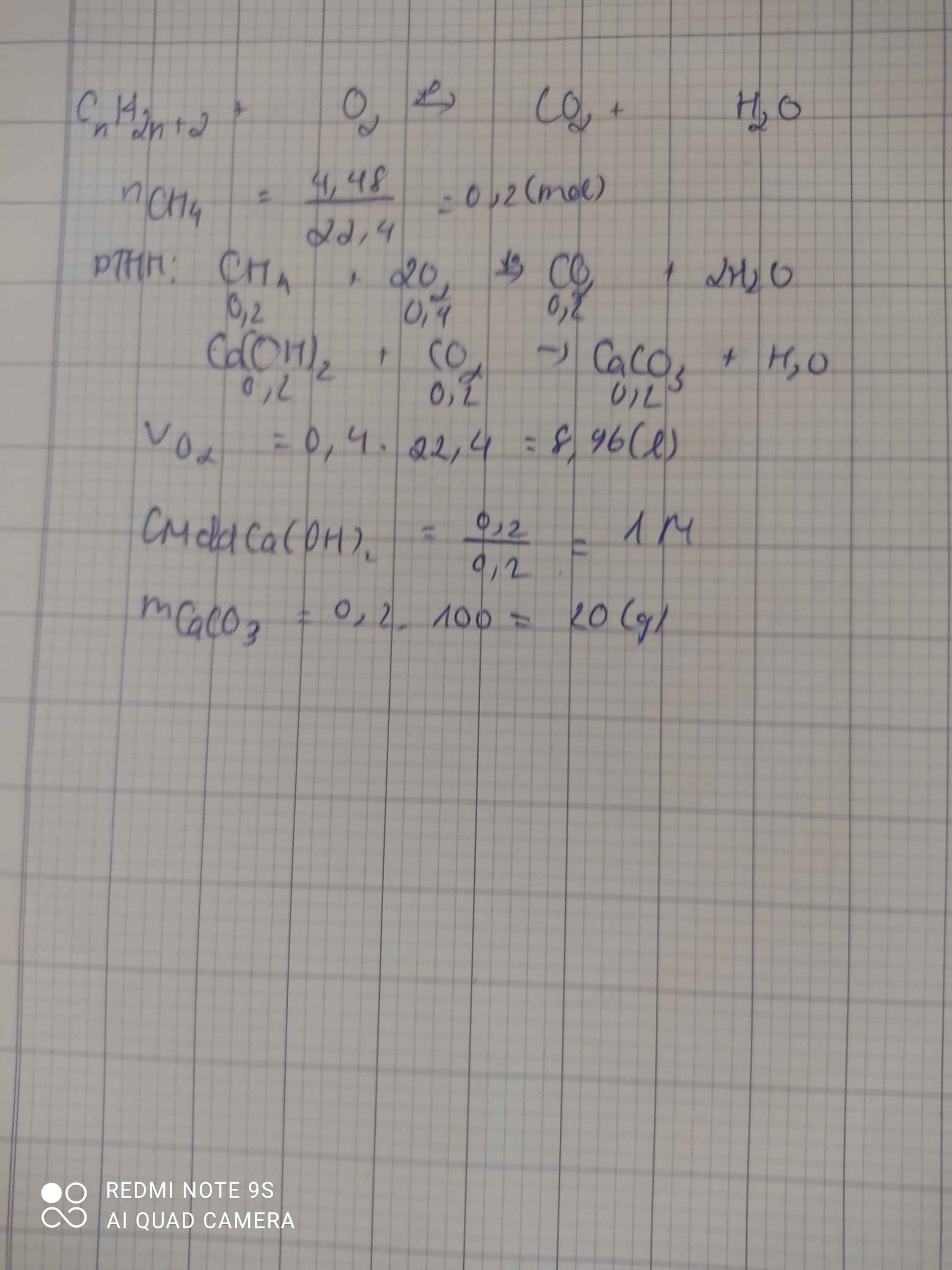
\(n_{CaCO_3}=\dfrac{25}{100}=0.25\left(mol\right)\)
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\)
\(0.25...........0.25...........0.25\)
\(C_{M_{Ca\left(OH\right)_2}}=\dfrac{0.25}{0.1}=2.5\left(M\right)\)
\(CH_4+2O_2\underrightarrow{t^0}CO_2+2H_2O\)
\(0.25..............0.25\)
\(V_{CH_4}=0.25\cdot22.4=5.6\left(l\right)\)
a) nCaCO3=0,25(mol)
CH4 + 2 O2 -to-> CO2 + 2 H2O
0,25<------------------0,25(mol)
CO2 + Ca(OH)2 -> CaCO3 + H2O
0,25<------0,25-----------0,25(mol)
b) CMddCa(OH)2= 0,25/0,1= 2,5(M)
b) V(CH4,đktc)=0,25.22,4=5,6(l)