
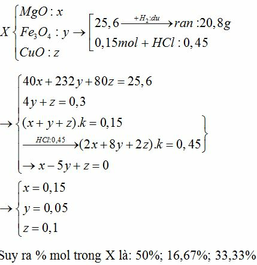
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

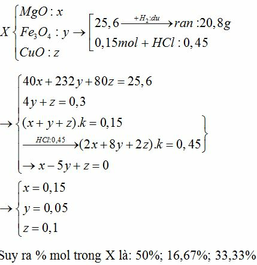

dung dịch HCl 0,2M chứ bạn
a) \({Fe_3O_4}+4{H_2}\)→\(3Fe+4{H_2O}\)
\(CuO+H_2\)→\(Cu+H_2O\)
\({Fe_3O_4}+8HCl\)→\({FeCl_2}+2{FeCl_3}+4H_2O\)
\(CuO+2HCl\)→\({CuCl_2}+H_2O\)
\(MgO+2HCl\)→\({MgCl_2}+H_2O\)
b)Gọi số mol \({Fe_3O_4}\),\(MgO,CuO\) trong 51,2g X là x,y,z
\(m_X=232x+40y+80z=51,2(g) (1)\)
Theo PT: \(n_{Fe}=3n_{Fe_3O_4}=3x(mol)\)
\(n_{Cu}=n_{CuO}=z(mol)\)
Chất rắn sau phản ứng gồm Fe,MgO,Cu
\(m_{rắn}=3x.56+40y+64z=41,6(g) \) (2)
0,15 mol X gấp a lần 51,2g X
→Trong 0,15 mol X có ax mol \({Fe_3O_4}\) ,ay mol MgO,az mol CuO
→ax+ay+az=0,15 (3)
\(n_{HCl}=0,225.2=0,045(mol) \)
Theo PTHH: \(n_{HCl}=8n_{Fe_3O_4}+2n_{MgO}+2n_{CuO}\)
→8ax+2ay+2az=0,45 (4)
Chia (4) cho (3) ta được: \(\dfrac{8x+2y+2z}{x+y+z}=3\)
→\(5x-y-z=0 \) (5)
Từ (1);(2);(5)→x=0,1;y=0,3;z=0,2
%\(n_{Fe_3O_4}=\dfrac{0,1}{0,1+0,3+0,2}.100=16,67\)%
%\(n_{MgO}=\dfrac{0,3}{0,1+0,3+0,2}.100=50\)%
%\(n_{CuO}=\)100%-16,67%-50%=33,33%

Đặt: nFe3O4= x mol
nMgO = y mol
nCuO= z mol
mX= 232x + 40y + 80z = 25.6g (1)
Fe3O4 + 4CO -to-> 3Fe + 4CO2
x________________3x
CuO + CO -to-> Cu + CO2
z_____________z
mCr= mFe + mMgO + mCu= 3x*56 + 40y + 64z = 20.8 g
<=> 168x + 40y + 64z = 20.8 (2)
Ta có :
Trong 0.15 mol hh có :
kx (mol) Fe3O4, ky (mol) MgO , kx (mol) CuO
nHCl= 0.45*1=0.45 mol
Fe3O4 + 8HCl --> FeCl2 + 2FeCl3 + 4H2O
kx______8kx
MgO + 2HCl --> MgCl2 + H2O
ky______2ky
CuO + 2HCl --> CuCl2 + H2O
kz______2kz
nHCl= 8kx + 2ky + 2kz = 0.45
<=> k(8x + 2y + 2z) = 0.45 (3)
nhh= k( x + y+ z ) = 0.15 (4)
Lấy (3) chia (4) :
(8x + 2y + 2z)/ (x+y+z) = 0.45/0.15=3
<=> 8x + 2y + 2z = 3x + 3y + 3z
<=> 5x -y - z = 0 (5)
Giải (1), (2) và (5) :
x= 0.05
y= 0.15
z=0.1
mFe3O4= 0.05*232=11.6g
mMgO= 0.15*40=6g
mCuO= 0.1*80=8g
%Fe3O4= 45.3125%
%MgO= 23.4375%
%CuO= 31.25%

PTHH: Fe3O4+4H2\(\underrightarrow{t^O}\)3Fe+4H2O
a 3a
CuO+H2\(\underrightarrow{t^O}\)Cu+H2O
c c
Fe3O4+8HCl\(\rightarrow\)FeCl2+2FeCl3+4H2O
ka 8ka
MgO+2HCl\(\rightarrow\)MgCl2+H2O
kb 2kb
CuO+2HCl\(\rightarrow\)CuCl2+H2O
kc 2kc
Đặt a,b,c lần lượt là số mol của Fe3O4, MgO,CuO trong 30,72 g X(a,b,c>0)\(\Rightarrow\)232a+40b+80c=30,72(1)
168a+40b+64c=24,96(2)
Đặt k là tỉ lề số phần mỗi chất trong 30,72 g X so với 0,18 mol X
\(\Rightarrow\)ka,kb,kc lần lượt là số mol của Fe3O4, MgO, CuO trong 0,18mol X
\(\Rightarrow\)ka+kb+kc=0,18(3)
Ta có:nHCl=0,54(mol)\(\Rightarrow\)8ka+2kb+2kc=0,54(4)
Từ (3) và (4), suy ra:-5a+b+c=0(5)
Từ(1), (2), (5), suy ra:a=0,06;b=0,18;c=0,12
Vậy:%nFe3O4=0,06:(0,06+0,18+0,12).100%=16,67%
%nMgO=0,18:(0,06+0,18+0,12)=50%
%nCuO=100%-16,67%-50%=33,33%

2H(Axit) + O(Oxit) → H2O
→ nH(Axit) = 2.nO(Oxit)
Gọi số mol của Fe3O4 và CuO lần lượt là x và y
BTNT O: 4x + y = 0,6
BTKL: 56 . 3x + 64y = 29,6
=> x = 0,1 và y = 0,2
=> %Fe3O4 = 59,18%
%CuO = 40,82%

Fe3O4+4CO=>3Fe+ 4CO2
CuO+CO=>Cu+CO2
Cr B gồm Fe Cu
HH khí D gồm CO dư và CO2
CO2 +Ca(OH)2=>CaCO3+H2O
p/100 mol<= p/100 mol
2CO2+Ca(OH)2 => Ca(HCO3)2
p/50 mol
Ca(HCO3)2+ 2NaOH=>CaCO3+ Na2CO3+2H2O
p/100 mol p/100 mol
Tổng nCO2=0,03p mol=nCO
=>BT klg
=>m+mCO=mCO2+mB=>mB=m+0,84p-1,32p=m-0,48p
c) hh B Fe+Cu
TH1: Fe hết Cu chưa pứ cr E gồm Ag Cu
dd Z gồm Fe(NO3)2
Fe+2Ag+ =>Fe2+ +2Ag
TH2:Cu pứ 1p cr E gồm Cu và Ag
Fe+2Ag+ => Fe2+ +2Ag
Cu+2Ag+ =>Cu2+ +2Ag
Dd Z gồm 2 muối của Fe2+ và Cu2+

H2,C,CO khử oxit kim loại từ ZnO trở đi trong dãy hoạt động hoá học. nên Co không khử được AL2O3 và MgO
=> đáp án D đúng

a/ Xác định kim loại M
nH2SO4 ban đầu = 78,4.6,25:100=0.05 mol
Goi số mol MO là a mol, mMO = (M+16).a
MO+H2SO4---MSO4+H2O(1)
a mol amol amol
Số mol axit dư sau phản ứng (1): 0,05-a mol
mdd sau phản ứng: (m+16)a+78,4
Theo bài ra ta có: 2,433=100.(0,05-a).98/[(m+16)a+78,4] (I)
Mặt khác: MO+CO---M+CO2 (2)
a mol a mol a mol amol
Theo bài ra CO2 tham gia phản ứng hết, các phản ứng có thể xảy ra:
CO2+2NaOH--->Na2CO3+H2O
b 2b b b
CO2+NaOH--->NaHCO3
c c c
Khối lượng muối tạo thành: 100b+84c=2,96
- Nếu NaOH dư không xảy ra phản ứng (3). Tức là c = 0 mol,
b = a = 2,96 : 106 = 0,028 mol. Thay a = 0,028 vào (I) ta tìm được M = 348,8 (loại).
- Nếu NaOH phản ứng hết: 2b + c = 0,5 . 0,1 = 0,05 (III)
Từ (II) và (III) ta có : 106 b + 84(0,05 – 2b) = 2,96
62b = 1,24 suy ra: b= 0,02 và c = 0,01
Theo 2, 3 và 4, n co2 = 0,03= n MO = a = 0,03.
Thay giá trị a = 0,03 và (I) ta có: 0,07299M = 4,085
M = 56 vậy kim loại M là Fe, mMO=(56+16).0,03= 2,16 g
b/ Dung dịch E gồm FeSO4 0,03 mol và H2SO4 dư 0,02 mol. Khi cho Al phản ứng hoàn toàn tạo 1,12 gam chất rắn, H2SO4 phản ứng hết.
2Al+3H2SO4---->Al2(SO4)3+3H2
2Al+3FeSO4----->Al2(SO4)3+3Fe
Khối lượng Fe trong dung dịch E : 56 . 0,03 = 1,68 gam > 1,12 gam
Như vậy FeSO4 còn dư thì Al tan hết. Vây t = 1,12: 56 =0,02 mol
Vây n Al = 0,04 : 3 + 0,04:3 = (0,08 : 3) mol
Vây khối lượng x = 0,08: 3 . 27 = 0,72 gam