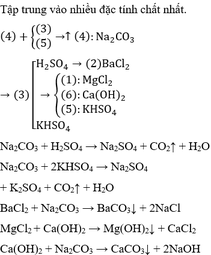Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Điều chế dung dịch BaCl2: Cho dung dịch Ba(OH)2 vào ống nghiệm, cho tiếp quỳ tím vào, quỳ tím hoá xanh. Cho từ từ dung dịch HCl vào đến khi quỳ chuyển sang màu tím thì dừng lại, ta điều chế được dd BaCl2
Ptpư: Ba(OH)2 + 2HCl → BaCl2 + 2H2O
- Lấy một lượng nhỏ từng dung dịch X, Y, Z cho vào từng ống nghiệm riêng biệt đánh số thứ tự
+ Cho dd BaCl2 vào từng ống nghiệm đến dư, các ống nghiệm đều tạo kết tủa trắng: Kết tủa từ X chứa BaCO3; từ Y chứa BaSO4; từ Z chứa hỗn hợp BaCO3 và BaSO4.
Ptpư: K2CO3 + BaCl2 → BaCO3 + 2KCl
K2SO4 + BaCl2 → BaSO4 + 2KCl
+ Cho dung dịch HCl tới dư vào từng ống nghiệm chứa các kết tủa: Nếu kết tủa nào tan hết thì ban đầu là dd X, nếu kết tủa tan một phần thì đó là dd Z, còn lại là dd Y
BaCO3 + 2HCl → BaCl2 + CO2 + H2O
tham khảo đi

Khi cho từng chất tác dụng với các chất còn lại ta có kết quả theo bảng sau:
| Na2CO3 | BaCl2 | HCl | H2SO4 | NaCl | |
| Na2CO3 | - | KT | Khí | Khí | - |
| BaCl2 | Kt | - | - | Kt | - |
| HCl | khí | - | - | - | - |
| H2SO4 | Khí | KT | - | - | - |
| NaCl | - | - | - | - | - |
Từ bảng trên dễ thấy chất (1) tác dụng với 2 chất có thể tạo ra kết tủa -->BaCl2
và ống (2) chứa Na2CO3 , ống (5) là H2SO4 (không thẻ ngược lại vì nếu ống (2) là H2SO4 thì ống (3) phải là Na2CO3 thế không còn chất ở ống (5) td với ống (1) tạo Kt)
--> ống 3 tác dụng với Na2CO3 tạo ra khí --. là chứa HCl
-->ống (4) chứa NaCl

- (NH4)2SO4,NaCl là ống 1
- BaCl2,NaOH là ống 2
- KNO3, Pb(NO3)2 là ống 3
Phân biệt :
Nhỏ Ba(OH)2 vào các ống nghiệm.
- Ống 1 có khí mùi khai, kết tủa trắng.
- Ống 2 không hiện tượng.
- Ống 3 có kết tủa trắng.
PTHH:
NH4)2SO4+Ba(OH)2→BaSO4+2NH3+2H2O
Pb(NO3)2+Ba(OH)2→Pb(OH)2+Ba(NO3)2

a) Htg: Ban đầu quỳ tím hóa xanh(NaOH bđ), sau đó chuyển về màu tím(Na2SO4) , rồi quỳ tím chuyển thành màu đỏ (H2SO4 dư)
2NaOH+ H2SO4 ---> Na2SO4 + 2H2O
b) Htg: Đầu tiên ko có hiện tượng gì rồi một thời gian sau thấy dd có màu hồng (NaOH dư )
HCl + NaOH --> NaCl+ H2O
c) Htg: - Mẩu Na tan dần di chuyển nhanh trên mặt nước, và có sủi bọt khí do:
2Na + 2H2O---> 2NaOH + H2
- dd từ màu đỏ nâu chuyển sang ko màu đồng thời xuất hiện ktua nâu đỏ
FeCl3+ 3NaOH ---> Fe(OH)3 + 3NaCl
d) Cho mẩu Na vào dung dịch BaCl2
d) Htg: - Mẩu Na tan dần di chuyển nhanh trên mặt nước, và có sủi bọt khí do:
2Na + 2H2O---> 2NaOH + H2
e) Htg: - Mẩu Na tan dần di chuyển nhanh trên mặt nước, và có sủi bọt khí do:
2Na + 2H2O---> 2NaOH + H2
- Xuất hiện ktua trắng keo
2AlCl3 + 6NaOH---> 2Al(OH)3 + 6NaCl
g) Htg: - Mẩu Na tan dần di chuyển nhanh trên mặt nước, và có sủi bọt khí do:
2Na + 2H2O---> 2NaOH + H2
- Xuất hiện ktua trắng keo, ktua đạt đến cực đại sau đó tan dẫn đến hết
2AlCl3 + 6NaOH---> 2Al(OH)3 + 6NaCl
Al(OH)3 + NaOH ---> NaAlO2 + 2H2O
h)Htg: - Sắt tan dần, dd từ ko màu rồi chuyển sang màu đỏ nâu và có khí màu hắc thoát ra, một thời gian sau thầy dd màu đỏ nâu chuyển về ko màu(Fe dư)
2Fe + 3H2SO4---> Fe2(SO4)3 + 3SO2 + 3H2O
Fe + Fe2(SO4)3 ---> 3FeSO4
k) Cho mẩu Kali vào dung dịch FeSO4 để trong không khí
k) Htg: - Mẩu K tan dần và có sủi bọt khí do:
2K + 2H2O---> 2KOH + H2
- dd từ màu trắng xanh dần chuyển sang ko màu đồng thời cuất hiện ktua màu trắng xanh. Để kết tủa ngoài không khí một thời gian thì ta thu đc kết tủa màu nâu đỏ
2KOH + FeSO4 ---> Fe(OH)2 + K2SO4
4Fe(OH)2 + O2 + 2H2O---> 4Fe(OH)3

dd 2 tác dụng với dd 3 & 4 cho kết tủa
\(\rightarrow\) dd 2 là BaCl2 ; dd 3&4 có thể là H2SO4 hoặc Na2CO3
dd 6 tác dụng với 1 & 4 cho kết tủa
\(\rightarrow\) dd 6 là MgCl2 ; kết hợp TN1 suy ra dd 4 là Na2CO3 ; vậy dd 1 là NaOH
Kết hợp TN1 và TN2 suy ra dd 3 là H2SO4 ; vậy dd 5 còn lại là HCl ( Các chất đã chọn thỏa mãn TN3)
Vậy ....
Ciao_

2 Lấy cùng một thể tích dd NaOH cho vào 2 cốc thủy tinh riêng biệt. Giả sử lúc đó mối cốc chứa a mol NaOH.
Sục CO2 dư vào một cốc, phản ứng tạo ra muối axit.
CO2 + 2NaOH → Na2CO3 + H2O (1)
CO2 + Na2CO3 + H2O → 2NaHCO3 (2)
Theo pt (1,2) nNaHCO3 = nNaOH = a (mol)
* Lấy cốc đựng muối axit vừa thu được đổ từ từ vào cốc đựng dung dịch NaOH ban đầu. Ta thu được dung dịch Na2CO3 tinh khiết
NaHCO3 + NaOH → Na2CO3 + H2O
1.Kết tủa A là BaSO4, dung dịch B có thể là H2SO4 dư hoặc Ba(OH)2
TH1: Dung dịch B là H2SO4 dư
Dung dịch C là Al2(SO4)3 ; Kết tủa D là Al(OH)3
TH2: Dung dịch B là Ba(OH)2
Dung dịch C là: Ba(AlO2)2 ; Kết tủa D là BaCO3
các pthh
BaO + H2SO4 → BaSO4 + H2O
BaO + H2O → Ba(OH)2
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Al2(SO4)3 + 3Na2CO3 + 3H2O → 2Al(OH)3 + 3CO2 + 3Na2SO4
Ba(OH)2 + 2H2O + 2Al → Ba(AlO2)2 + 3H2
Ba(AlO2)2 + Na2CO3 → BaCO3 + 2NaAlO2

- Dùng quỳ tím
+) Hóa xanh: NaOH
+) Không đổi màu: NaNO3 và Na2SO4
- Đổ dd BaCl2 vào 2 dd còn lại
+) Xuất hiện kết tủa: Na2SO4
PTHH: BaCl2 + Na2SO4 → 2NaCl + BaSO4 ↓
+) Không hiện tượng: NaNO3

+ Cho A tác dụng với dd NaOH dư:
Chất rắn A1: Fe3O4, Fe; dd B1: NaAlO2 và NaOH dư; khí C1: H2
+ Cho khí C1 tác dụng với A1
Fe3O4 + 2H2 ---> 3Fe + 4H2O.
Chất rắn A2: Fe, Al, Al2O3
+ Cho A2 tác dụng H2SO4 đặc nguội.
Al2O3+ 3H2SO4---->Al2(SO4)3+3H2O
Dd B2: Al2(SO4)3
+ Cho B2 tác dụng với dd BaCl2
Al2(SO4)3+ 3BaCl2--->2AlCl3+3BaSO4
B3: BaSO4
Xác định được các chất: A1, A2, B1, B2, B3, C1

Bài 1
\(n_{Fe}=\frac{5,6}{56}=0,1\left(mol\right)\)
\(n_{Al}=\frac{a}{27}\left(mol\right)\)
TN1: \(Fe+2HCl-->FeCl2+H2\)
----0,1-------0,2------------------0,1---0,1(mol)
dd sau pư là FeCl2 và có thể có HCl dư
TN2 : \(2Al+3H2SO4-->Al2\left(SO4\right)3+3H2\)
-------a/27-----\(\frac{a}{40,5}\)---------------------\(\frac{a}{13,5}\)-----------\(\frac{a}{40,5}\)(mol)
dd sau pư là Al2(SO4)3 và có thể có thêm H2SO4
Vì sau khi phản ứng cái kim đồng hồ cân nặng vẫn ở vị trí cân bằng nên ta có
\(m_{Fe}-m_{H2}=m_{Al}-m_{H2}\)
\(\Leftrightarrow5,6-0,2=a-\frac{a}{20,25}\)
\(\Leftrightarrow5,4=\frac{19,25a}{20,25}\)
\(\Leftrightarrow109,35=19,25a\)
\(\Rightarrow a\approx5,68\)(g)
Bài 2
\(H2SO4+BaCl2-->BaSO4+2HCl\)
a) Ta có
\(n_{H2SO4}=\frac{38,168.19,6\%}{98}=0,08\left(g\right)\)
\(n_{BaCl2}=\frac{208.10\%}{208}=0,1\left(mol\right)\)
=> BaCl2 dư. Muối sau pư là BaCl2 dư
\(n_{BaSO4\downarrow}=n_{H2SO4}=0,08\left(mol\right)\)
\(m_{BaSO4}=0,08.233=18,64\left(g\right)\)
\(n_{BaCl2}=n_{H2SO4}=0,08\left(mol\right)\)
\(\Rightarrow n_{BaCl2}dư=0,1-0,08=0,02\left(mol\right)\)
\(m_{BaCl2}=0,02.208=4,16\left(g\right)\)
b) dd sau pư là BaCl2 dư và HCl
\(mdd=m_{ddH2SO4}+m_{ddBaCl2}-m_{BaSO4}=38,168+208-18,64=227,528\left(g\right)\)
\(m_{HCl}=0,08.36,5=2,92\left(g\right)\)
\(C\%_{HCl}=\frac{2,92}{277,528}.100\%=1,05\%\)
\(C\%_{BaCl2}dư=\frac{4,16}{277,528}.100\%=1,5\%\)