Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

pt:2Fe+3H2SO4\(\rightarrow\)Fe2SO4+H2
a)nFe=\(\frac{m}{M}\)=\(\frac{22,4}{56}\) =0,4(mol)
nFe2(SO4)3=\(\frac{m}{M}\)=\(\frac{24,5}{340}\)=0,07(mol)
Theo pt ta có tỉ lệ :
\(\frac{0,4}{2}>\frac{0,07}{1}\)
=>nFe dư , nFe2(SO4)3
nên ta tính theo nFe2(SO4)3
=> nFe dư = nFe đề bài - nFe phản ứng
= 2-0,2=1,8(mol)
=>mFe = n x M = 1,8 x 56 = 100,8(g)
b) Theo pt: nH2 = nFe = 1,8 (mol)
VH2 = n x 22,4 = 1,8 x 22,4 = 40,32 (l)

a) nFe=0,4(mol); nH2SO4=0,5(mol)
PTHH: Fe + H2SO4 -> FeSO4 + H2
Ta có: 0,4/1 < 0,5/1
=> Fe hết, H2SO4 dư. tính theo nFe.
=> nH2= nH2SO4(p.ứ)=nFe=0,4(mol)
=>nH2SO4(dư)=0,5-0,4=0,1(mol)
=>H2SO4(dư)=0,1.98=9,8(g)
b) V(H2,dktc)=0,4.22,4=8,96(l)

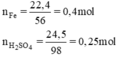
Phương trình hóa học của phản ứng:

So sánh tỉ lệ 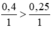 ⇒ Fe dư
⇒ Fe dư
Theo PT nFe (pư) = nH2SO4 = 0,25 mol ⇒ nFe dư = 0,4 – 0,25 = 0,15 mol
mFe dư = 0,15. 56 = 8,4g.
Do khối lượng Fe dư nên tính thể tích khí H2 theo số mol H2SO4.
nH2 = nH2SO4 = 0,25 mol
Vkhí = 0,25 . 22,4 = 5,6l.

Bai2:
nZn=m/M=19,5/65=0,3(mol)
PT:
Zn + H2SO4 -> ZnSO4 +H2
1..........1...............1.............1 (mol)
0,3 -> 0,3 -> 0,3 -> 0,3 (mol)
=> mZnSO4=n.M=0,3.161=48,3(gam)
b) VH2=n.22,4=0,3.22,4=6,72(lít)
c) nCuO=m/M=16/80=0,2 (mol)
PT:
CuO +H2 -> Cu +H2O
1...........1........1.......1 (mol)
0,2 -> 0,2 -> 0,2 -> 0,2 (mol)
Chất dư là H2
Số mol H2 dư là: 0,3 -0,2 =0,1 (mol)
= >mH2=n.M=0,1.2=0,2(gam)
nFe=m/M=22,4/56=0,4 (mol)
nH2SO4=m/M=24,5/98=0,25(mol)
PT:
Fe + H2SO4 -> FeSO4 +H2
1........1..............1............1 (mol)
0,25 <- 0,25-> 0,25 -> 0,25 (mol)
VH2=n.22,4=0,25.22,4=5,6(lít)
Chất dư là Fe
Số mol Fe dư là: 0,4 -0,25=0,15(mol)
=> mFe dư=n.M=0,15.56=8,4(gam)

Bài 1
Fe+ H2SO4--->FeSO4 +h2
a) Ta có
n\(_{Fe}=\)\(\frac{2,24}{56}=0,04\left(mol\right)\)
n\(_{H2SO4}=\frac{24,5}{98}=0,25\left(mol\right)\)
=>H2SO4 dư
Theo pthh
n\(_{H2}=n_{Fe}=0,04\left(mol\right)\)
V\(_{H2}=0,04.22,4=0,896\left(l\right)\)
b) Theo pthh
n\(_{H2SO4}=n_{Fe}=0,04\left(mol\right)\)\
n\(_{H2SO4}dư=0,25-0,04=0,21\left(mol\right)\)
m\(_{H2SO4}dư=0,21.98=20,58\left(g\right)\)
nFe= \(\frac{22,4}{56}\) =0,4(mol)
nH2SO4= \(\frac{24,5}{98}\) = 0,25(mol)
PTHH:
2Fe + 3H2SO4 -------> Fe2SO4 + H2 ↑
2mol__ 3mol_________1mol__1mol
0,4___0,25mol
Lập tỉ lệ: \(\frac{0,4}{2}\) > \(\frac{0,25}{3}\)
⇒ Fe dư, H2SO4 hết
a) Theo pt: nH2H2 = nH2SO4H2SO4 = 0,25 mol
⇒VH2=0,25⋅22,4=5,6(l)
b) Sắt thừa sau phản ứng:
Theo pt nFe(pư) = nH2SO4 = 0,25 mol
⇒mFe(pư) = 0 ,25⋅56 = 14(g)⇒mFe(pư) = 0,25⋅56 = 14(g)
mFe (dư) = 22,4 - 14 = 8,4 g

\(n_{Mg}=\frac{m}{M}=\frac{9,6}{24}=0,4mol\)
PTHH: \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\)
1 : 1 : 1 : 1 mol
0,4 0,4 0,4 0,4 mol
a. \(m_{MgSO_4}=n.M=0,4.\left(24+32+16.4\right)=48g\)
b. \(V_{H_2}=n.22,4=0,4.22,4=8,96l\)
c. \(n_{Fe_2O_3}=\frac{m}{M}=\frac{64}{56.2}+16.3=0,4mol\)
PTHH: \(3H_2+Fe_{2O_3}\rightarrow2Fe+3H_2O\left(ĐK:t^o\right)\)
3 : 1 : 2 : 3 mol
1, 7 0,4 0,8 1,2 mol
\(m_{Fe}=n.M=0,8.56=44,8g\)

a) PTHH là: 2Al + H2SO4 → Al2(SO4) + H2.
Tỉ lệ giữa số nguyên tử Al lần lượt với số phân tử của ba chất trong phản ứng đều là 2:1
b) nAl =27/27 = 1 (mol)
theo PTHH ta có: số mol của H2SO4 = 1/2 * nAl = 1/2*1 =0.5 (mol)
khối lượng của H2SO4 là: 0.5 * (1*2+32+16*4) =49 (g).

Câu 1:
\(n_{Al}=\dfrac{m}{M}=\dfrac{8,1}{27}=0,3mol\)
\(n_{H_2SO_4}=\dfrac{200.14,7}{98.100}=0,3mol\)
2Al+3H2SO4\(\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
-Tỉ lệ: \(\dfrac{0,3}{2}>\dfrac{0,3}{3}\rightarrow\)Al dư, H2SO4 hết
\(n_{Al\left(pu\right)}=\dfrac{2}{3}n_{H_2SO_4}=\dfrac{2}{3}.0,3=0,2mol\)
\(n_{Al\left(dư\right)}=0,3-0,2=0,1mol\)
\(n_{H_2}=n_{H_2SO_4}=0,3mol\)
\(V_{H_2}=0,3.22,4=6,72l\)
\(n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{3}n_{H_2SO_4}=\dfrac{1}{3}.0,3=0,1mol\)
\(m_{Al_2\left(SO_4\right)_3}=0,1.342=34,2gam\)
\(m_{dd}=8,1+200-0,1.27-0,3.2=204,8gam\)
C%Al2(SO4)3=\(\dfrac{34,2}{204,8}.100\approx16,7\%\)
Câu 2:
\(n_{MgO}=\dfrac{4}{40}=0,1mol\)
\(n_{H_2SO_4}=\dfrac{200.19,6}{98.100}=0,4mol\)
MgO+H2SO4\(\rightarrow\)MgSO4+H2O
-Tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,4}{1}\rightarrow\)H2SO4 dư
\(n_{H_2SO_4\left(pu\right)}=n_{MgO}=0,1mol\)\(\rightarrow\)\(n_{H_2SO_4\left(dư\right)}=0,4-0,1=0,3mol\)
\(m_{H_2SO_4}=0,1.98=9,8gam\)
\(n_{MgSO_4}=n_{MgO}=0,1mol\)
\(m_{dd}=4+200=204gam\)
C%H2SO4(dư)=\(\dfrac{0,3.98}{204}.100\approx14,4\%\)
C%MgSO4=\(\dfrac{0,1.120}{204}.100\approx5,9\%\)

\(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right);n_{H_2SO_4}=\dfrac{24,5}{98}=0,25\left(mol\right)\\ Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ Vì:\dfrac{0,4}{1}>\dfrac{0,25}{1}\Rightarrow Fe.dư\\ n_{H_2}=n_{H_2SO_4}=n_{Fe\left(p.ứ\right)}=0,25\left(mol\right)\\ a,V_{H_2\left(đktc\right)}=0,25.22,4=5,6\left(l\right)\\ b,n_{Fe\left(dư\right)}=0,4-0,25=0,15\left(mol\right)\\ m_{Fe\left(dư\right)}=0,15.56=8,4\left(g\right)\)
cảm ơn bạn