Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a. PTHH:
Cu + HCl ---x--->
Fe + 2HCl ---> FeCl2 + H2
Vậy chất rắn A là Cu.
b. Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: \(n_{Fe}=n_{H_2}=0,3\left(mol\right)\)
=> \(m_{Fe}=0,3.56=16,8\left(g\right)\)
=> \(\%_{m_{Fe}}=\dfrac{16,8}{30}.100\%=56\%\)
\(\%_{m_{Cu}}=100\%-56\%=44\%\%\)
c.
Theo PT: \(n_{FeCl_2}=n_{Fe}=0,3\left(mol\right)\)
=> \(m_{FeCl_2}=0,3.127=38,1\left(g\right)\)
d.
Ta có: \(m_{dd_{FeCl_2}}=100+16,8=116,8\left(g\right)\)
=> \(C_{\%_{FeCl_2}}=\dfrac{38,1}{116,8}.100\%=32,62\%\)
ta có Cu ko phản ứng với HCl
-> V khí là do Fe phản ứng hết tạo ra
Fe + 2HCl -> FeCl2 + H2
0,3 .............................0,3
n H2 = 6,72 : 22,4=0,3 mol
m Fe = 0,3.56 =16,8 g
% Fe = 16,8 : 30 .100 = 56 %
% Cu = 100% - 56% = 44%

m dd sau pư = mFe + m dd HCl - mH2 thôi em nhé, Cu không phản ứng nên không cộng thêm vào.
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a) Theo Pt : \(n_{H2}=n_{Fe}=n_{FeCl2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(\%m_{Fe}=\dfrac{0,1.56}{10}.100\%=56\%\)
\(\%m_{Cu}=100\%-56\%=44\%\)
b) Theo Pt : \(n_{H2}=2n_{HCl}=2.0,1=0,2\left(mol\right)\)
\(\Rightarrow m_{ddHCl}=\dfrac{0,2.36,5}{7,3\%}.100\%=100\left(g\right)\)
c) \(m_{ddspu}=10+100-0,1.2=109,8\left(g\right)\)
\(C\%_{FeCl2}=\dfrac{0,1.127}{109,8}.100\%=11,57\%\)

\(n_{H_2}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(0.1.......0.2......................0.1\)
Chất rắn X : Cu
\(m_{Zn}=0.1\cdot65=6.5\left(g\right)\Rightarrow m_{Cu}=19.3-6.5=12.8\left(g\right)\)
\(n_{Cu}=\dfrac{12.8}{64}=0.2\left(mol\right)\)
\(C_{M_{HCl}}=\dfrac{0.2}{0.2}=1\left(M\right)\)
\(2Cu+O_2\underrightarrow{^{^{t^o}}}2CuO\)
\(0.2........0.1\)
\(m_{tăng}=m_{O_2}=0.1\cdot32=3.2\left(g\right)\)

\(a.2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ A:Al_2\left(SO_4\right)_3\\ B:Cu\\ D:H_2\\ b.n_{H_2}=n_{H_2SO_4}=\dfrac{200.18,375\%}{100\%.98}=0,375mol\\ V_{H_2}=0,375.22,4=8,4l\\ c.n_{Al}=\dfrac{0,375.2}{3}=0,25mol\\ m_{Al}=0,25.27=6,75g\\ m_{Cu}=19,55-6,75=12,8g\\ d.n_{Al_2\left(SO_4\right)_3}=\dfrac{0,375}{3}=0,125mol\\ m_{dd}=6,75+200-0,375.2=206g\\ m_{Al_2\left(SO_4\right)_3}=0,125.342=42,75g\\ C_{\%_{Al_2\left(SO_4\right)_2}}=\dfrac{42,75}{206}\cdot100\%=20,75\%\)
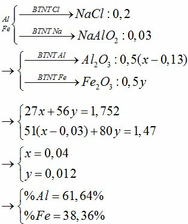
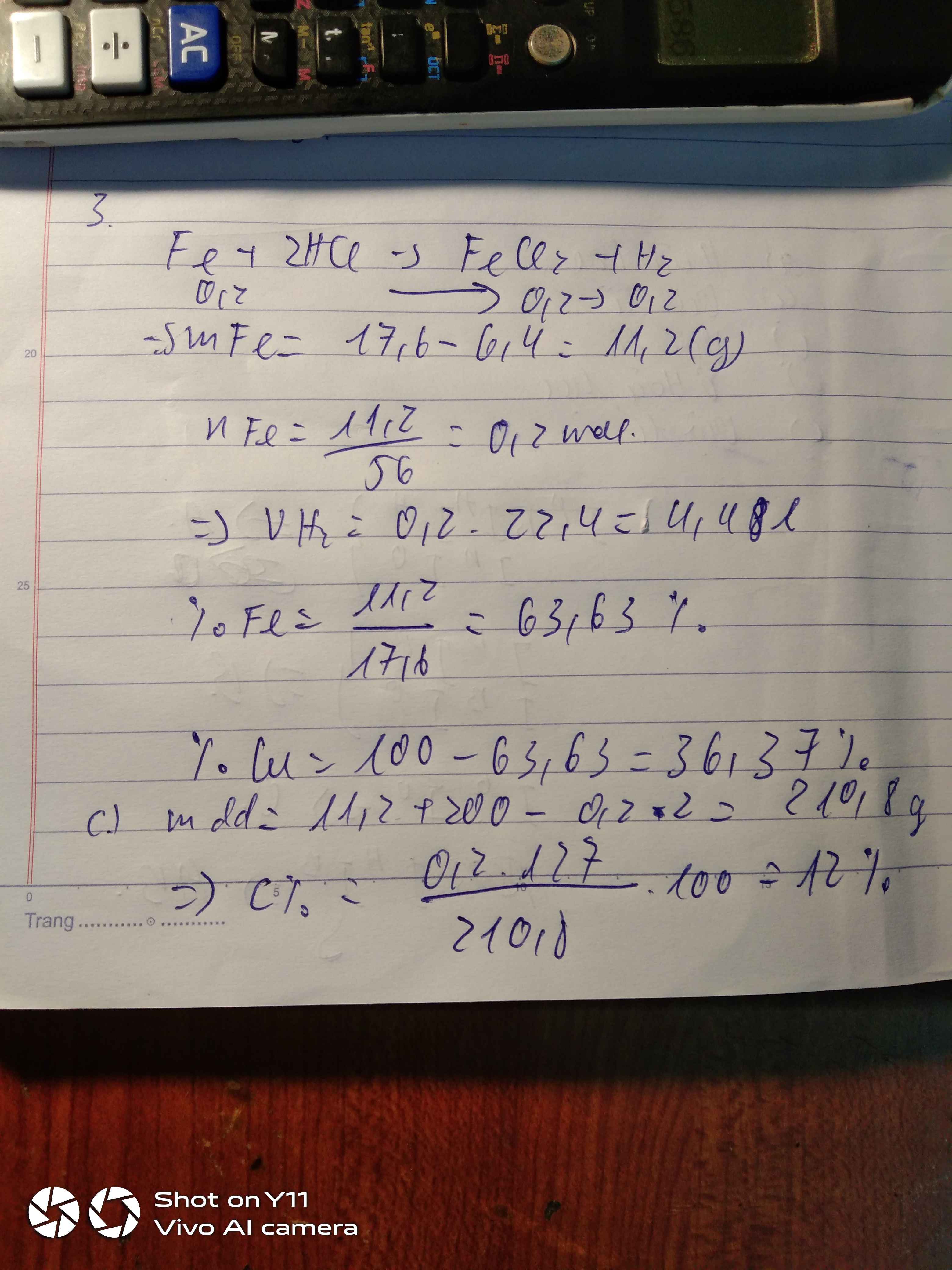
bạc không bị oxi hóa bởi không khí cũng như không phản ứng được với dd HCl , vì vậy hỗn hợp A sẽ gồm : CuO và Ag và chất rắn B sẽ là Ag , từ đó viết phương trình và tính toán bình thường .
giải chi tiết hộ cái