Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{FeO}=a\left(mol\right),n_{CuO}=b\left(mol\right)\)
\(m_{hh}=72a+80b=19.2\left(g\right)\left(1\right)\)
\(FeO+H_2SO_4\rightarrow FeSO_4+H_2O\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(n_{H_2SO_4}=a+b=0.25\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.1,b=0.15\)
\(m_{FeO}=0.1\cdot72=7.2\left(g\right)\)
\(m_{CuO}=12\left(g\right)\)
\(C_{M_{FeSO_4}}=\dfrac{0.1}{0.25}=0.4\left(M\right)\)
\(C_{M_{CuSO_4}}=\dfrac{0.15}{0.25}=0.6\left(M\right)\)

Bài1:
a,Vì dd A là dd bazo nên làm cho quỳ tím đổi thành màu xanh
b,\(n_{Na_2O}=\dfrac{21,7}{62}=0,35\left(mol\right)\)
PTHH: Na2O + H2O → 2NaOH
Mol: 0,35 0,7
\(\Rightarrow C_{M_{ddNaOH}}=\dfrac{0,7}{0,4}=1,75M\)
Bài 2:
a,\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: Zn + 2HCl → ZnCl2 + H2
Mol: 0,15 0,3 0,15
⇒ a=mZn = 0,15.65 = 9,75 (g)
b,\(V_{HCl}=\dfrac{0,3}{1,5}=0,2\left(l\right)=200\left(ml\right)\)

a, PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
b, Ta có: \(n_{H_2}=0,15\left(mol\right)\)
Theo PT: \(n_{Al}=\dfrac{2}{3}n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{Al}=0,1.27=2,7\left(g\right)\)
\(\Rightarrow m_{Al_2O_3}=7,8-2,7=5,1\left(g\right)\)
c, Có: \(n_{Al_2O_3}=\dfrac{5,1}{102}=0,05\left(mol\right)\)
Theo PT: \(n_{HCl}=3n_{Al}+6n_{Al_2O_3}=0,6\left(mol\right)\)
\(n_{AlCl_3}=n_{Al}+2n_{Al_2O_3}=0,2\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,6.36,5=21,9\left(g\right)\Rightarrow m_{ddHCl}=\dfrac{21,9}{10\%}=219\left(g\right)\)
⇒ m dd sau pư = 7,8 + 219 - 0,15.2 = 226,5 (g)
\(\Rightarrow C\%_{AlCl_3}=\dfrac{0,2.133,5}{226,5}.100\%\approx11,79\%\)
Bạn tham khảo nhé!

\(a/\\MgO+2HCl \to MgCl_2+H_2O\\ n_{MgO}=\frac{8}{40}=0,2(mol)\\ b/\\ n_{HCl}=0,2.2=0,4(mol)\\ CM_{HCl}=\frac{0,4}{0,2}=2M\)

Bài 4 :
\(n_{MgO}=\dfrac{4}{40}=0,1\left(mol\right)\)
300ml = 0,3l
\(n_{HCl}=1.0,3=0,3\left(mol\right)\)
1) Pt : \(MgO+2HCl\rightarrow MgCl_2+H_2O|\)
1 2 1 1
0,1 0,3 0,1
2) Lập tỉ số so sánh : \(\dfrac{0,1}{1}< \dfrac{0,3}{2}\)
⇒ MgO phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol của MgO
\(n_{MgCl2}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
⇒ \(m_{MgCl2}=0,1.95=9,5\left(g\right)\)
\(n_{HCl\left(dư\right)}=0,3-\left(0,1.2\right)=0,1\left(mol\right)\)
⇒ \(m_{HCl\left(dư\right)}=0,1.36,5=3,65\left(g\right)\)
\(m_{ddHCl}=1,14.300=342\left(g\right)\)
\(m_{ddspu}=4+342=346\left(g\right)\)
\(C_{MgCl2}=\dfrac{9,5.100}{346}=2,75\)0/0
\(C_{HCl\left(dư\right)}=\dfrac{3,65.100}{346}=1,05\)0/0
Chúc bạn học tốt

a) Vì: mA < 400 (g) nên phải có khí thoát ra → muối có dạng MHSO4 và khí là: CO2
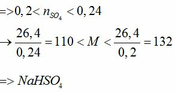
b)
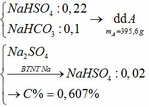
c) Tác dụng được với: MgCO3, Ba(HSO3)2, Al2O3, Fe(OH)2, Fe, Fe(NO3)2
Pt: 2NaHSO4 + MgCO3 → Na2SO4 + MgSO4 + CO2↑ + H2O
2NaHSO4 + Ba(HSO3)2 → BaSO4 + Na2SO4 + SO2↑ + 2H2O
6NaHSO4 + Al2O3 → 3Na2SO4 + Al2(SO4)3 + 3H2O
2NaHSO4 + Fe(OH)2 → Na2SO4 + FeSO4 + 2H2O
2NaHSO4 + Fe → Na2SO4 + FeSO4 + H2↑
12NaHSO4 + 9Fe(NO3)2 → 5Fe(NO3)3 + 2Fe2(SO4)3 + 6Na2SO4 + 3NO↑ + 6H2O
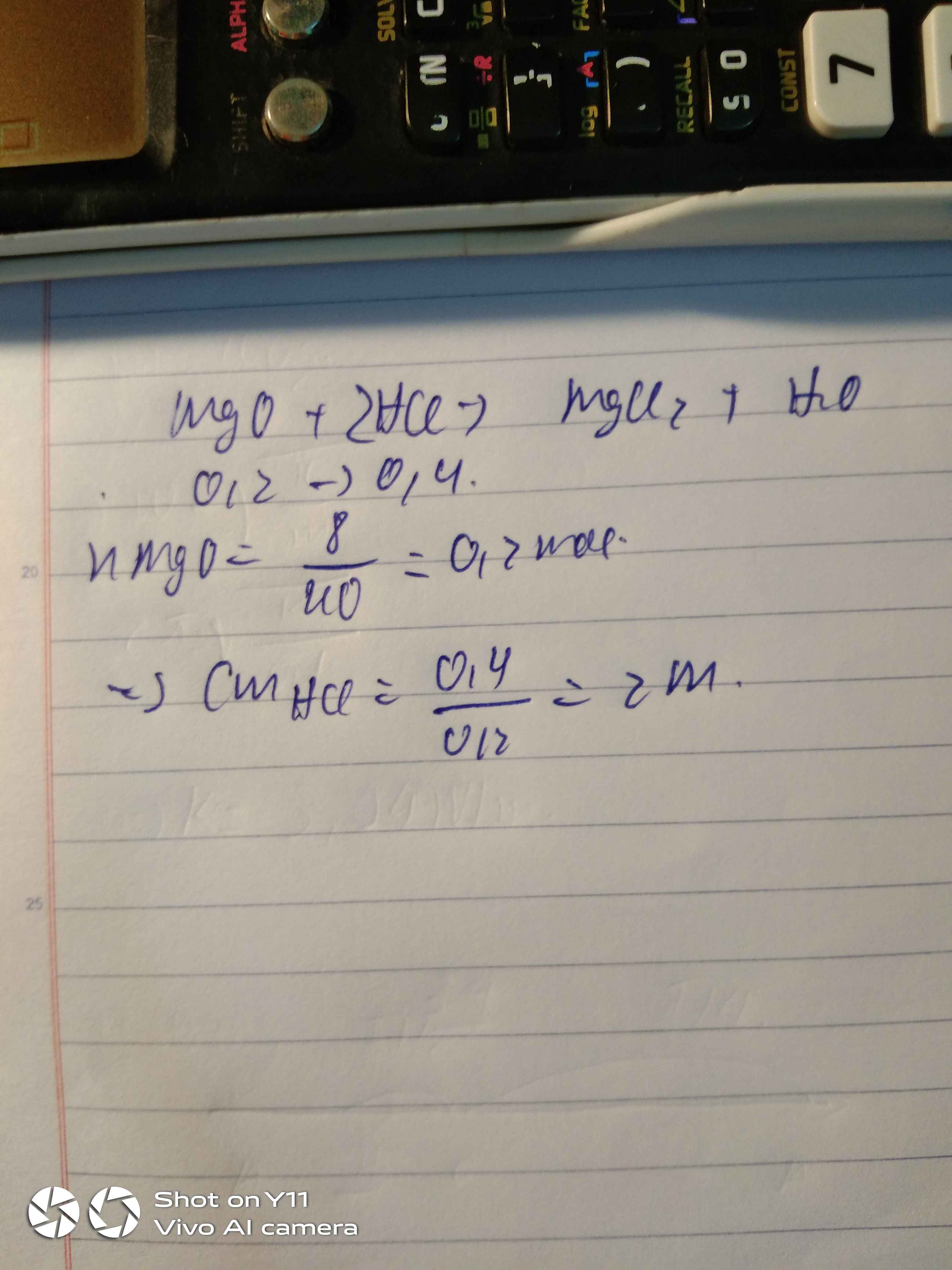
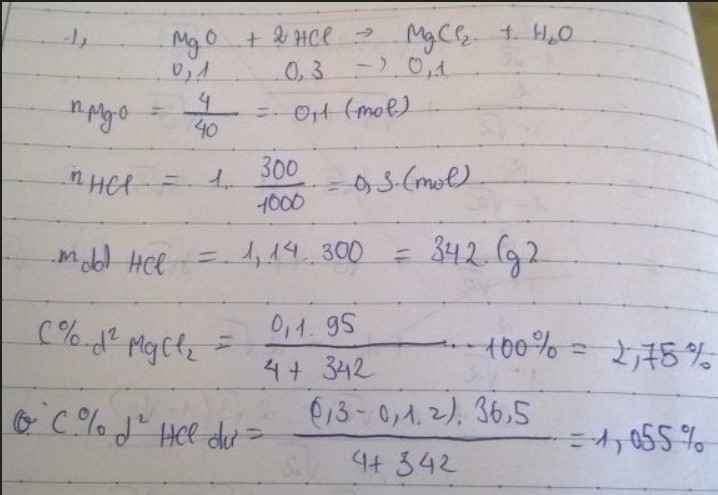
a)
$Al_2O_3 + 6HCl \to 2AlCl_3 + 3H_2O$
b)
n HCl = 0,4.1,5 = 0,6(mol)
n Al2O3 = 1/6 n HCl = 0,1(mol) => m = 0,1.102 = 10,2(gam)
n AlCl3 = 1/3 n HCl = 0,2(mol) => CM AlCl3 = 0,2/0,4 = 0,5M
nHCl = 0.4*1.5 = 0.6 (mol)
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
nAlCl3 = 0.6*2/6 = 0.2 (mol)
mAlCl3 = 0.2*133.5 = 26.7 (g)
CM AlCl3 = 0.2/0.4 = 0.5 (M)