Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
\(n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)\\ n_{Mg} = a\ mol; n_{Fe} = b\ mol\\ Mg + 2HCl \to MgCl_2 + H_2\\ Fe + 2HCl \to FeCl_2 + H_2 \)
Theo PTHH, ta có:
\(\left\{{}\begin{matrix}24a+56b=5,2\\a+b=0,15\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,1\\b=0,05\end{matrix}\right.\)
Suy ra:
\(\%m_{Mg} = \dfrac{0,1.24}{5,2}.100\% = 46,15\%\\ \%m_{Fe} = 100\% - 46,15\% = 53,85\% \)
b)
\(n_{HCl} = 2n_{H_2} = 0,15.2 = 0,3(mol)\\ \Rightarrow V_{dd\ HCl} = \dfrac{0,3}{1} = 0,3(lít) \)
Đặt :
nMg = a mol
nFe= b mol
mhh = 24a + 56b = 5.2 (g) (1)
Mg + 2HCl => MgCl2 + H2
Fe + 2HCl => FeCl2 + H2
nH2 = a + b = 0.15 (2)
(1) , (2)
a = 0.1
b = 0.05
%Mg = 2.4/5.2 * 100% = 46.15%
%Fe = 100 - 46.15 = 53.85%
nHCl = 2a + 2b = 0.05 * 2 + 0.1*2 = 0.3 (mol)
VddHCl = 0.3/1=0.3 (l)

\(1)n_{H_2}=\dfrac{3,36}{22,4}=0,15(mol)\\ Mg+2HCl\to MgCl_2+H_2\\ Fe+2HCl\to FeCl_2+H_2\)
Từ giả thiết và theo PT:
\(\begin{cases} 24n_{Mg}+56n_{Fe}=5,2\\ n_{Mg}+n_{Fe}=0,15 \end{cases}\\ \Rightarrow n_{Mg}=0,1(mol);n_{Fe}=0,05(mol)\)
\(\Rightarrow \begin{cases} \%m_{Mg}=\dfrac{0,1.24}{5,2}.100\%=46,15\%\\ \%m_{Fe}=100-46,15=53,85\% \end{cases}\\ 2)\Sigma n_{HCl}=2n_{H_2}=0,3(mol)\\ \Rightarrow V_{dd_{HCl}}=\dfrac{0,3}{1}=0,3(l)=300(ml)\)
lười làm thì đừng làm
box hóa có luật không tham khảo rồi

PTHH:
\(CuO+H_2\) \(\underrightarrow{t^o}\) \(Cu+H_2O\) \(\left(1\right)\)
\(Fe_2O_3+3H_2\) \(\underrightarrow{t^o}\) \(2Fe+3H_2O\) \(\left(2\right)\)
Số mol H2 là 0,6 mol
Gọi số mol H2 tham gia pư 1 là x mol \(\left(0,6>x>0\right)\)
Số mol H2 tham gia pư 2 là \(\left(0,6-x\right)mol\)
Theo PTHH 1:
\(n_{CuO}=n_{H_2}=x\left(mol\right)\)
Theo PTHH 2:
\(n_{Fe_2O_3}=\frac{1}{3}n_{H_2}=\left(0,6-x\right):3\left(mol\right)\)
Theo bài khối lượng hh là 40g
Ta có pt: \(80x+\left(0,6-x\right)160:3=40\)
Giải pt ta được \(x=0,3\)
Vậy \(n_{CuO}=0,3\left(mol\right);n_{Fe_2O_3}=0,1\left(mol\right)\)
\(\%m_{CuO}=\left(0,3.80.100\right):40=60\%\)
\(\%m_{Fe_2O_3}=\left(0,1.160.100\right):40=40\%\)
1)
PTHH: \(2Cu+O_2\) \(\underrightarrow{t^o}\) \(2CuO\)
x x
Gọi số mol Cu phản ứng là x mol ( x >0)
Chất rắn X gồm CuO và Cu
Ta có PT: 80x + 25,6 – 64x = 28,8
Giải PT ta được x = 0,2
Vậy khối lượng các chất trong X là:
\(m_{Cu}\) = 12,8 gam
\(m_{CuO}\) = 16 gam
2)
Gọi kim loại hoá trị II là A.
PTHH: \(A+2HCl\rightarrow ACl_2+H_2\)
Số mol \(H_2\)= 0,1 mol
Theo PTHH: \(n_A=n_{H_2}\)= 0,1 (mol)
Theo bài \(m_A\) = 2,4 gam \(\Rightarrow\) \(M_A\) = 2,4 : 0,1 = 24 gam
Vậy kim loại hoá trị II là Mg

\(a) \\ Fe + H_2SO_4 \to FeSO_4 + H_2\\ Fe_2O_3 + 3H_2SO_4 \to Fe_2(SO_4)_3 + 3H_2O\\ b) \text{Theo PTHH} : \\ n_{Fe} = n_{H_2} = \dfrac{2,24}{22,4} = 0,1(mol)\\ \%m_{Fe} = \dfrac{0,1.56}{8} .100\% = 70\%\\ \%m_{Fe_2O_3} = 100\% -70\% = 30\%\)
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ PTHH:Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ \left(mol\right).....0,1...........................\leftarrow0,1\\ m_{Fe}=0,1.56=5,6\left(g\right)\\ m_{Fe_2O_3}=\Sigma m_{hh}-m_{Fe}=8-5,6=2,4\left(g\right)\\ PTHH:Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\\ \left\{{}\begin{matrix}\%m_{Fe}=\dfrac{5,6}{8}.100\%=70\%\\\%m_{Fe_2O_3}=\dfrac{2,4}{8}.100\%=30\%\end{matrix}\right.\)

Gọi: \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\) ⇒ 27x + 56y = 5,5 (1)
PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Fe}=\dfrac{3}{2}x+y=\dfrac{4,48}{22,4}=0,2\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,1.27}{5,5}.100\%\approx49,09\%\\\%m_{Fe}\approx50,91\%\end{matrix}\right.\)

Gọi \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo pt: \(\Rightarrow\left\{{}\begin{matrix}3x+y=0,2\\27x+56y=5,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=\dfrac{19}{470}\\y=\dfrac{37}{470}\end{matrix}\right.\)
\(\%m_{Al}=\dfrac{\dfrac{19}{470}\cdot27}{5,5}\cdot100\%=19,84\%\)
\(\%m_{Fe}=100\%-19,84\%=80,16\%\)

a,Fe + 2HCl → FeCl + H2 (1)
FeO + 2HCl → FeCl + H2O (2)
nH2 = 3,36/ 22,4 = 0,15 ( mol)
Theo (1) nH2 = nFe = 0,15 ( mol)
mFe = 0,15 x 56 = 8.4 (g)
m FeO = 12 - 8,4 = 3,6 (g)
a, \(n_{H_2}=\frac{3,36}{22,4}=0,15\left(mol\right)\)
\(Fe+2HCl->FeCl_2+H_2\left(1\right)\)
\(FeO+2HCl->FeCl_2+H_2O\left(2\right)\)
theo (1) \(n_{Fe}=n_{H_2}=0,15\left(mol\right)\)
=> \(m_{Fe}=0,15.56=8,4\left(g\right)\)
=> \(m_{FeO}=12-8,4=3,6\left(g\right)\)

ta thấy : nFe =nH2 = 0,15
=> mFe =0,15 x 56 = 8,4g
%Fe=8,4/12 x 100 = 70%
=>%FeO = 100 - 70 = 30%
b) BTKLra mdd tìm mct of HCl
c) tìm mdd sau pứ -mH2 nha bạn
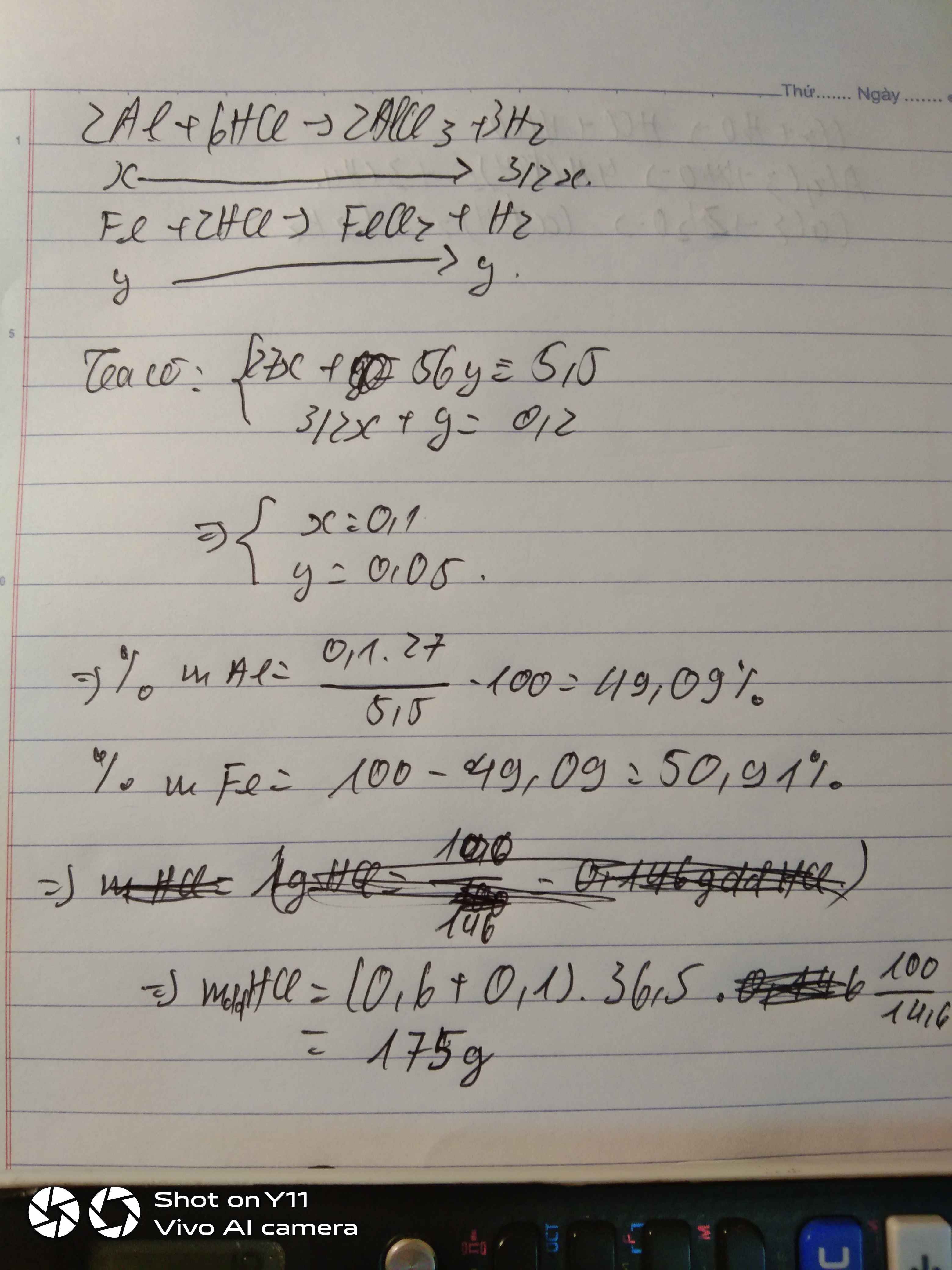
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
_____0,15<--------------------0,15
=> mFe = 0,15.56 = 8,4(g)
=> \(\left\{{}\begin{matrix}\%Fe=\dfrac{8,4}{24,4}.100\%=34,426\%\\\%Fe_2O_3=100\%-34,426\%=65,574\%\end{matrix}\right.\)