Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
$Cu + 2H_2SO_4 \to CuSO_4 + SO_2 + H_2O$
$2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O$
b) n Cu =a (mol) ; n Fe = b(mol)
=> 64a + 56b = 12(1)
n SO2 = a + 1,5b = 5,6/22,4 = 0,25(2)
(1)(2) suy ra a = b = 0,1
%m Cu = 0,1.64/12 .100% = 53,33%
%m Fe = 100% -53,33% = 46,67%
c)
n CuSO4 = a = 0,1(mol)
n Fe2(SO4)3 = 0,5a = 0,05(mol)
m muối = 0,1.160 + 0,05.400 = 36(gam)
d) n H2SO4 = 2n SO2 = 0,5(mol)
V H2SO4 = 0,5/2 = 0,25(lít)

a)
Gọi : \(\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\)⇒ 27a + 56b = 1,66(1)
\(2Al + 6HCl \to 2AlCl_3 + 3H_2\\ Fe +2 HCl \to FeCl_2 + H_2\)
Theo PTHH :
\(n_{H_2} = 1,5a + b = \dfrac{1,12}{22,4} = 0,05(2)\)
Từ (1)(2) suy ra a = 0,02 ; b = 0,02
Vậy :
\(\%m_{Al} = \dfrac{0,02.27}{1,66}.100\% = 32,53\%\\ \%m_{Fe} = 100\% - 32,53\% = 67,47\%\)
a)
\(n_{HCl} = 2n_{H_2} = 0,05.2 = 0,1(mol)\\ \Rightarrow C\%_{HCl} = \dfrac{0,1.36,5}{100}.100\% = 3,65\%\)

Theo đề bài ta có bột S dư nên Fe, Zn tác dụng hết với S.
a)Phương trình hóa học của phản ứng.
Zn + S -> ZnS Fe + S -> FeS
x mol x mol y mol y mol
ZnSO4 + H2SO4 -> ZnSO4 + H2S
x mol x mol
FeSO4 + H2SO4 -> FeSO4 + H2S
x mol y mol
Ta có hệ phương trình :
Giải hệ phương trình => x = 0,04 (mol), y = 0,02 (mol).
Vậy mZn = 0,04.65 = 2,6g
mFe = 0,02.56 = 1,12g.

-
Fe2O3 + 6HCl --> 2FeCl3 + 3H2O
Mg + 2HCl --> MgCl2 + H2
-
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
\(n_{HCl}=\dfrac{200.18,25}{100.36,5}=1\left(mol\right)\)
PTHH: Mg + 2HCl --> MgCl2 + H2
0,2<----0,4<---------------0,2
Fe2O3 + 6HCl --> 2FeCl3 + 3H2O
0,1<-----0,6
=> \(\left\{{}\begin{matrix}\%Mg=\dfrac{0,2.24}{0,2.24+0,1.160}.100\%=23,077\%\\\%Fe_2O_3=\dfrac{0,1.160}{0,2.24+0,1.160}.100\%=76,923\%\end{matrix}\right.\)

\(n_{Cu}=a\left(mol\right),n_{Fe}=b\left(mol\right)\)
\(m_X=64a+56b=16.2\left(g\right)\left(1\right)\)
\(n_{SO_2}=\dfrac{8.96}{22.4}=0.4\left(mol\right)\)
Bảo toàn e :
\(2a+3b=0.4\cdot2=0.8\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.0475,b=0.235\)
\(\%Cu=\dfrac{0.0475\cdot64}{16.2}\cdot100\%=18.76\%\)
\(\%Fe=81.24\%\)
\(b.\)
\(\dfrac{a}{b}=\dfrac{0.0475}{0.235}=\dfrac{19}{94}\)
\(\Rightarrow n_{Cu}=19x\left(mol\right),n_{Fe}=94x\left(mol\right)\)
\(m_X=19x\cdot64+94x\cdot56=22\left(g\right)\)
\(\Rightarrow x=\dfrac{11}{3240}\)
\(n_{H_2}=n_{Fe}=\dfrac{11}{3240}\cdot94=\dfrac{517}{1620}\left(mol\right)\)
\(V_{H_2}=7.15\left(l\right)\)
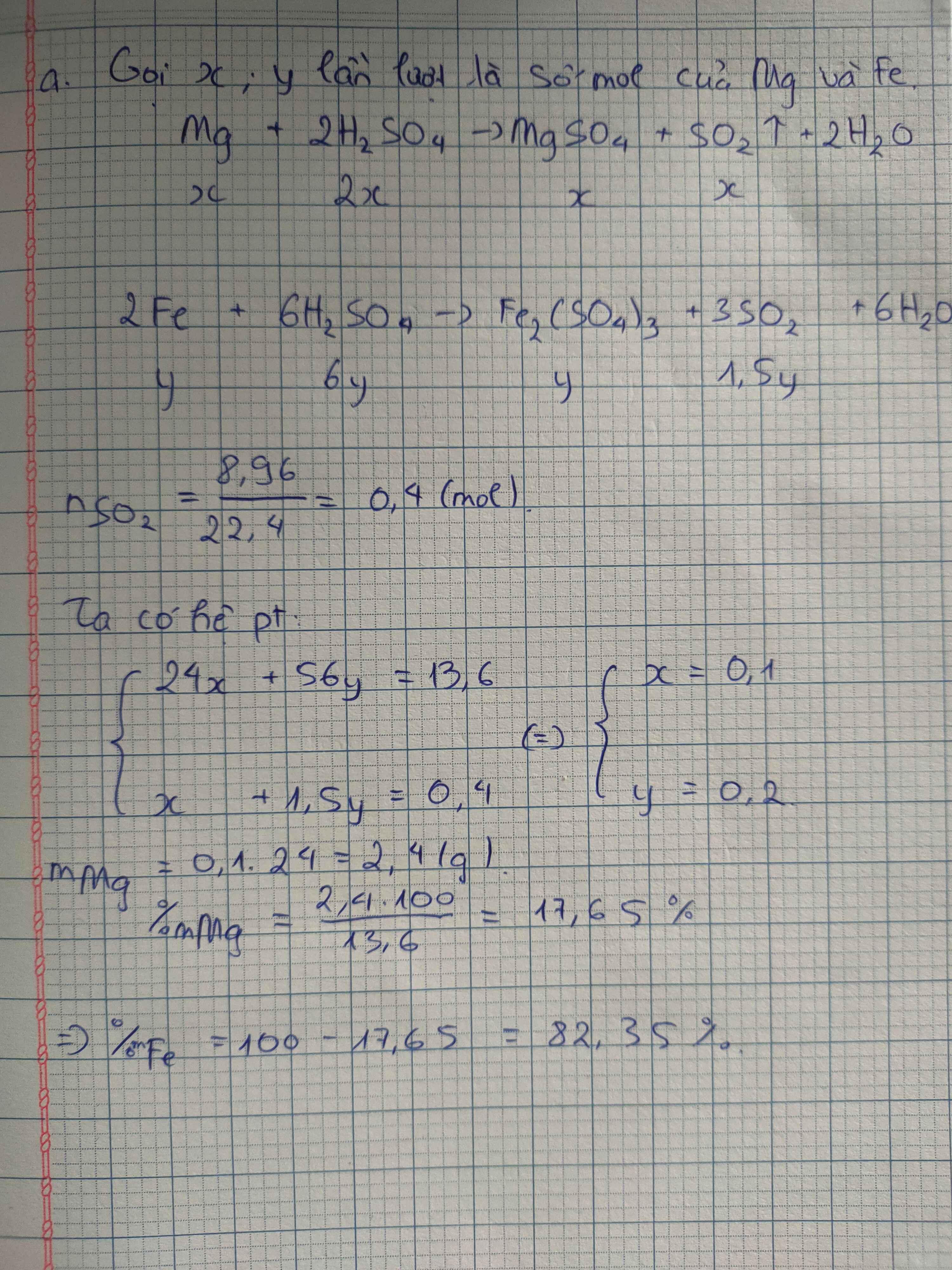




a, 2Fe + 6H2SO4 \(\rightarrow\) Fe2(SO4)3 + 6H2O + 3SO2
Mg + 2H2SO4\(\rightarrow\) MgSO4 + 2H2O + SO2
b,Bảo toàn electron ta có: \(n_{SO2}=\frac{8,96}{22,4}=0,4\left(mol\right)\)
\(Fe^0\rightarrow Fe^{+3}+3e\) \(S^{+6}+2e\rightarrow S^{+4}\)
x (mol) 3x 0,8 0,4 (mol)
\(Mg^0\rightarrow Mg^{+2}+2e\) ta có hpt\(\left\{{}\begin{matrix}3x+2y=0,8\\56x+24y=13,6\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,1\left(mol\right)\end{matrix}\right.\)
y 2y (mol)
%mFe=82,35%
%mMg=17,65%
c, \(n_{NaOH}=0,1\times1=0,1\left(mol\right)\)
ta có\(\frac{n_{OH^-}}{n_{SO2}}=\frac{0,1}{0,4}=0,25< 1\) nên tạo ra muối \(NaHSO_3\)
\(SO_2+NaOH\rightarrow NaHSO3\)
0,4 0,4
vậy \(m_{mu\text{ối}}=0,4\times\left(23+1+32+16\times3\right)=41,6\)