Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giả sử toàn bộ Na → NaNO3 ⇒ nhiệt phân tạo thành NaNO2
⇒ mNaNO2 = 0,4 × 69 = 27,6 > 26,44 ⇒ Có NaOH dư.
+ Đặt nNaNO2 = a và nNaOHdư = b
⇒ Ta có hệ:
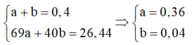
+ Nhận thấy nHNO3 = 0,6 mol nhưng nNO3– = 0,36 mol
⇒ nN bay ra theo khí = 0,6 – 0,36 = 0,24 mol.
+ Ta có nHNO3 pứ = nN/Cu(NO3)2 + nN bay ra theo khí = 2nCu + 0,24 = 0,56 mol
Đáp án A

Giả sử NaOH phản ứng đủ ⇒ nNaNO3 = nNaOH = 0,4 mol
⇒ rắn chứa 0,4 mol NaNO2 ⇒ mNaNO2 = 0,4 × 69 = 27,6(g) > 26,44(g).
⇒ vô lí ⇒ NaOH dư
Giải hệ có 0,04 mol NaOH và 0,36 mol NaNO2.
nCu2+ = nCu = 0,16 mol; nNO3–/A = 0,36 mol. Bảo toàn điện tích:
nH+ dư = 0,36 - 0,16 × 2 = 0,04 mol ⇒ nH+ phản ứng = 0,2 × 3 - 0,04 = 0,56 mol.
⇒ nHNO3 phản ứng = 0,56 mol
Đáp án D

Đáp án B
Giả sử KOH không dư ⇒ nKNO2 = nKOH = 0,5 mol ⇒ mrắn ≥ mKNO2 = 42,5(g)
⇒ vô lí! ⇒ KOH dư. Đặt nKNO3 = x; nKOH dư = y. Bảo toàn nguyên tố Kali: x + y = 0,5.
Rắn gồm KNO2 và KOH dư ⇒ 85x + 56y = 41,05 ⇒ giải hệ có: x = 0,45 mol; y = 0,05 mol.
Đặt nFe = a; nCu = b ⇒ mA = 56a + 64b = 11,6(g)
16(g) rắn gồm Fe2O3 và CuO.
⇒ 160.0,5a + 80b = 16
⇒ giải hệ có: a = 0,15 mol; b = 0,05 mol.
nHNO3 = 0,7 mol; nNO3–/X = nKNO3 = 0,45 mol. Bảo toàn nguyên tố Nitơ: nN/B = 0,25 mol.
Bảo toàn nguyên tố Hidro: nH2O = 0,35 mol. Bảo toàn nguyên tố Oxi: nO/B = 0,4 mol.
⇒ Bảo toàn khối lượng: mX = 11,6 + 87,5 – 0,25 × 14 – 0,4 × 16 = 89,2(g).
-> nNO3–/X < 3nFe + 2nCu ⇒ X gồm muối Fe(NO3)2, Fe(NO3)3 và Cu(NO3)2.
Giải hệ có: nFe(NO3)3 = 0,05 mol
⇒ C%Fe(NO3)3 = 0,05 × 242 ÷ 89,2 × 100% = 13,56%

Giả sử KOH không dư
⇒ nKNO2 = nKOH = 0,5 mol
⇒ mrắn ≥ mKNO2 = 42,5(g)
⇒ vô lí!. ⇒ KOH dư.
Đặt nKNO3 = x; nKOH dư = y.
Bảo toàn nguyên tố Kali: x + y = 0,5.
Rắn gồm KNO2 và KOH dư
⇒ 85x + 56y = 41,05
⇒ giải hệ có: x = 0,45 mol; y = 0,05 mol.
● Đặt nFe = a; nCu = b
⇒ mA = 56a + 64b = 11,6(g)
16(g) rắn gồm Fe2O3 và CuO.
⇒ 160.0,5a + 80b = 16
⇒ giải hệ có: a = 0,15 mol; b = 0,05 mol.
nHNO3 = 0,7 mol; nNO3–/X = nKNO3 = 0,45 mol.
Bảo toàn nguyên tố Nitơ: nN/B = 0,25 mol.
Bảo toàn nguyên tố Hidro: nH2O = 0,35 mol.
Bảo toàn nguyên tố Oxi: nO/B = 0,4 mol.
⇒ Bảo toàn khối lượng:
mX = 11,6 + 87,5 – 0,25 × 14 – 0,4 × 16 = 89,2(g).
► nNO3–/X < 3nFe + 2nCu
⇒ X gồm muối Fe(NO3)2, Fe(NO3)3 và Cu(NO3)2.
Giải hệ có: nFe(NO3)3 = 0,05 mol
⇒ C%Fe(NO3)3 = 0,05 × 242 ÷ 89,2 × 100% = 13,56%
Đáp án B


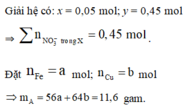
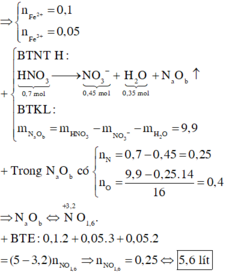
Do KOH dư ⇒ kết tủa hết ion kim loại ⇒ nung T thì rắn gồm Fe2O3 và CuO.
⇒ mrắn = 41,05 = 0,5a × 160 + 80b. Giải hệ có: a = 0,15 mol; b = 0,05 mol.
Quy hỗn hợp B về N và O. Bảo toàn nguyên tố nitơ có nN spk = 0,7 – 0,45 = 0,25 mol.

⇒ bảo toàn nguyên tố oxi có nO sk = 0,7 × 3 – 0,45 × 3 – 0,35 = 0,4 mol.
⇒ BTKL mdung dịch sau phản ứng = 11,6 + 87,5 – 0,25 × 14 – 0,4 × 16 = 89,2 gam.
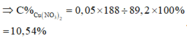
Đáp án C

Đáp án B
Trong T có KNO3
KN O 3 → t 0 KN O 2 + 0,5 O 2
Nếu trong T không có KOH, vậy khối lượng chất rắn thu được sau khi nhiệt phân T là khối lượng của KNO2.
mKNO2 = 0,5. 85 = 42,5 > 41,05
=> T gồm KOH dư và KNO2
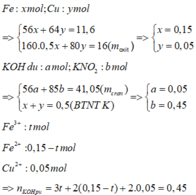

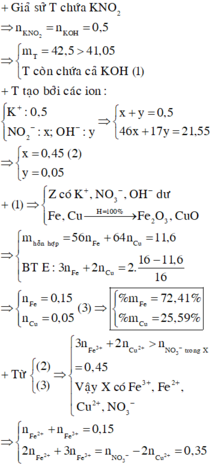




⇒ Số mol Cu = 0,12 mol
+) Dựa vào "Hòa tan hết 10,24 gam Cu" + "Số mol HNO3 đã phản ứng với Cu" ⇒ dd X có HNO3 dư.
+) NaOH cho vào X thì tác dụng lần lượt HNO3 dư và Cu(NO3)2.
+) Hiển nhiên HNO3 hết và NaOH tiếp tục phản ứng với Cu(NO3)2.
+) Nếu Cu(NO3)2 dư thì cô cạn dung dịch thu được Cu(NO3)2 là chất rắn ⇒ nung lên thu được 26,44 g CuO ⇒ nCu = nCuO = 0,3305 > 0,12.
⇒ NaOH dư.
⇒ Cô cạn dung dịch được NaOH, NaNO3 đem nung thu được 22,64 g NaOH, NaNO2 là chất rắn.
Đặt ẩn ra cho số mol NaOH = x và số mol NaNO2 = y ⇒ 40x + 69y = 26,44
Bảo toàn nguyên tố Na ban đầu thì x + y = 0,4
⇒ x = 0,04; y = 0,36 mol
⇒ nHNO3 dư = 0,36 – 0,32 = 0,04 mol
⇒ nHNO3 pứ với Cu = 0,6 – 0,04 = 0,56 mol
Đề này 26,44 mới đúng bạn ơi; 23,44 số lẻ .
Ta có:
\(n_{Cu}=\frac{10,24}{64}=0,16\left(mol\right)\)
\(n_{HNO3}=0,2.3=0,6\left(mol\right)\)
\(n_{NaOH}=0,4.1=0,4\left(mol\right)\)
Dung dịch A chứa Cu(NO3)2 và HNO3 có thể dư.
Khi cho NaOH vào có 2 trường hợp xảy ra.
TH1: NaOH hết cô cạn dung dịch thu được rắn chỉ chứa NaNO3
\(\Rightarrow n_{NaNO3}=n_{NaOH}=0,4\left(mol\right)\)
Nung rắn:
\(2NaNO_3\rightarrow2NaNO_2+O_2\)
\(\Rightarrow n_{NaNO2}=n_{NaNO3}=0,4\left(mol\right)\)
\(\Rightarrow m_{NaNO2}=0,4.69=27,6>26,44\) (loại)
TH2: NaOH dư.
Cô cạn dung dịch thu được NaNO3 x mol và NaOH dư y mol.
Nung rắn thu được NaNO2 x mol và NaOH dư y mol.
\(\Rightarrow\left\{{}\begin{matrix}x+y=0,4\\69x+40y=26,44\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,36\\y=0,04\end{matrix}\right.\)
\(\Rightarrow n_{N\left(trong.khí\right)}=0,6-0,36=0,24\left(mol\right)\)
Bảo toàn N:
\(n_{HNO3\left(pư\right)}=n_{N\left(trong.khi\right)}+2n_{Cu\left(NO3\right)2}=0,16.2+0,240,56\left(mol\right)\)