Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án B
nKOH = 1,5 (mmol) → mKOH = 84 (mg)
→ Để trung hòa 1 gam chất béo cần 6 (mg) KOH → chỉ số axit của chất béo trên là 6.
Khối lượng KOH cần = 10 × 5,6 = 56 (mg)

Số mol KOH là: nKOH = 0,003. 0,1 = 0,0003 (mol)
Khối lượng KOH cần dùng là mKOH = 0,0003.56 = 0,0168 (g) = 16,8 (mg)
Trung hòa 2,8 gam chất béo cần 16,8 mg KOH
⇒ Trung hòa 1 gam chất béo cần x mg KOH
⇒ x = 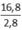 = 6
= 6
Vậy chỉ số axit của mẫu chất béo trên là 6.

\(n_{H^+}=n_{OH^-}=0,003.0,1=3.10^{-4}\left(mol\right)\)
\(m_{KOH}=3.10^{-4}.56=0,0168\left(g\right)\)
\(0,0168\left(g\right)KOH\rightarrow2,8\left(g\right)chấtbeo\\ x\left(g\right)KOH\rightarrow1\left(g\right)chấtbeo\)
=> \(x=\dfrac{0,0168.1}{2,8}=6,10^{-3}\left(g\right)=6\left(miligam\right)\)
Vậy chỉ số của mẫu axit trên là 6

nKOH=15/1000.0,1=1,5.10^(-3) mol
=>mKOH=1,5.10^(-3).56=0,084g
Chỉ số axit là số mg KOH để trung hòa hết axit tự do trong 1g chất béo
Theo đề bài trung hòa axit trong 14g chất béo cần 0,084 gam KOH
=>trung hòa 1 gam chất béo cần 0,006 gam KOH=6mg KOH
Chỉ số axit=6

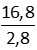 = 6
= 6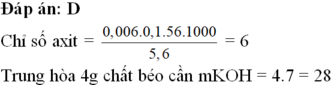
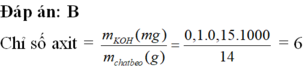
mKOH= 15.0,1.56= 84 mg
=> số miligam KOH cần dùng để trung hòa lượng axit tự do trong 1g mẫu chất béo là:\(\frac{84}{14}\) = 6 mg
=> chỉ số axit của mẫu chất béo đó là : 6
Chỉ số axit = mKOH/m chất béo pư = 0,015.0,1.56.1000/14 = 6