Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Số mol của nguyên tử lưu huỳnh là: 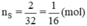
Số mol của nguyên tử oxi là: 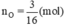
Ta có: 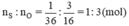
⇒ Trong một phân tử lưu huỳnh trioxit có 1 nguyên tử S và có 3 nguyên tử O.
Vậy công thức hóa học đơn giản nhất của oxit lưu huỳnh là SO3.

Giả sử khối lượng oxit là 10g ⇒ m F e = 7g ; m O = 3g
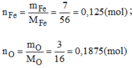
Vậy: 0,125 mol nguyên tử Fe kết hợp với 0,1875 mol nguyên tử O.
Suy ra 2 mol nguyên tử Fe kết hợp với 3 mol nguyên tử O (vì số nguyên tử luôn là số nguyên).
→ Công thức hóa học đơn giản của oxit sắt là: F e 2 O 3

a) Gọi CTHH của oxit sắt là FexOy ( x,y \(\in\) N* )
Theo đề , ta có: %mO = \(\frac{m_O}{m_{hc}}.100\%\)
=> 30% = \(\frac{16x}{56x+16y}.100\%\)
=> 0,3( 56x + 16y ) = 16y
=> 16,8x + 4,8y = 16y
=> 16,8x = 11,2y
=> \(\frac{x}{y}=\frac{11,2}{16,8}=\frac{2}{3}\)
Vậy CTHH cần tìm của oxit là Fe2O3
b) Gọi x,y lần lượt là số mol của Fe,O ( x,y > 0 )
Theo đề, ta có: \(\frac{m_{Fe}}{m_O}=\frac{7}{3}\)
=> \(\frac{56x}{16y}=\frac{7}{3}\)
=> 56x.3 = 16y.7
=> 168x = 112y
=> \(\frac{x}{y}=\frac{2}{3}\)

Gọi CTHH của oxit sắt là FexOy
Ta có: 56x÷16y=7÷3
⇔x÷y=7\56÷3\16=2\3
Vậy x=2 và y=3
Vậy CTHH của oxit sắt là Fe2O3
MFe2O3=56×2+16×3=160(g)
a,
Tỉ lệ khối lượng 7:3 nên nếu có 10 phần oxit thì sắt chiếm 7 phần, oxi 3 phần.
Giả sử có 10g oxit \(\rightarrow\) Có 7g Fe, 3g O
\(\Rightarrow n_{Fe}=0,125\left(mol\right);n_O=0,1875\left(mol\right)\)
\(n_{Fe}:n_O=0,125:0,1875=2:3\)
Vậy oxit là Fe2O3
b,
\(M=56.2+16.3=160\left(\frac{g}{mol}\right)\)
c,
\(n_{Fe2O3}=0,1\left(mol\right)\)
\(\Rightarrow\) Trong 0,1 mol oxit có 0,2 mol Fe và 0,3 mol O
Có \(0,2.6.10^{23}=1,2.10^{23}\) nguyên tử Fe và \(0,3.6.10^{23}=1,8.10^{23}\)
nguyên tử O.

Gọi CTHH của oxit sắt là FexOy
Ta có:
\(\dfrac{56x}{16y}=\dfrac{7}{3}\)
=>\(\dfrac{x}{y}=\dfrac{2}{3}\)
Vậy CTHH của oxit là Fe2O3
b;MFe2O3=56.2+16.3=160

Gọi CTHH của oxit sắt là FexOy
Ta có: \(56x\div16y=7\div3\)
\(\Leftrightarrow x\div y=\dfrac{7}{56}\div\dfrac{3}{16}=\dfrac{2}{3}\)
Vậy x=2 và y=3
Vậy CTHH của oxit sắt là Fe2O3
\(M_{Fe_2O_3}=56\times2+16\times3=160\left(g\right)\)
A, Gọi CTHH của oxit sắt là FexOy
Theo bài ta có :
\(\dfrac{56X}{16y}\)= \(\dfrac{7}{3}\)
=> 56x.3 = 16y.7
168x = 112y
=> \(\dfrac{x}{y}\) = \(\dfrac{112}{168}\)= \(\dfrac{2}{3}\)=
Vậy CTHH của oxit sắt cần tìm là Fe2O3
B, MFe2O3 = 56.2+16.3 = 160(g)

Câu 1
\(\%C:\%O=27,3:72,7\)
\(\Rightarrow n_C:n_O=\frac{27,2}{12}:\frac{72,7}{16}=2,2667:4,54\)
\(\approx1:2\)
\(PTK:1,52.29=44\)
=>CTHH:CO2
Câu 2: Một oxit phi kim có 1,86g photpho kết hợp với 2,4g oxit. Tìm CTHH đơn giản của oxit
\(n_P=\frac{1,86}{31}=0,06\left(mol\right)\)
\(n_{O2}=\frac{2,4}{16}=0,15\left(mol\right)\)
\(n_P:n_O=0,06:0,15=2:5\)
CTĐG:P2O5
Câu 3: Trong phòng thí nghiệm người ta điều chế oxit sắt từ Fe3O4
a) Tính số gam sắt và thể tích oxi cần dùng để có thể điều chế đc 2,32g oxit sắt từ
b) Tính số gam Kali penmanganat KMnO4 cần dùng để có đc lượng oxi dùng cho phản ứng trên
a)\(3Fe+2O2-->Fe3O4\)
\(n_{Fe3O4}=\frac{23,2}{232}=0,1\left(mol\right)\)
\(n_{Fe}=3n_{Fe3O4}=0,3\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,3.56=16,8\left(g\right)\)
\(n_{O2}=2n_{Fe3O4}=0,2\left(mol\right)\)
b)\(2KMnO4-->K2MnO4+MnO2+O2\)
\(n_{KMnO4}=2n_{O2}=0,4\left(mol\right)\)
\(m_{KMnO4}=0,4.158=63,2\left(g\right)\)
\(\Rightarrow V_{O2}=0,2.22,4=4,48\left(l\right)\)
A
nFe=nO=0,125mol