Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

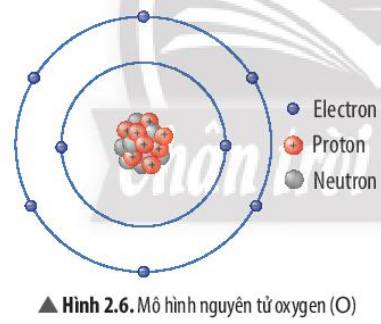
Số electron ở lớp ngoài cùng của nguyên tử Na =1
Số electron ở lớp ngoài cùng của ion Na+ =8
=>Số electron ở lớp ngoài cùng của ion Na+ nhiều hơn số electron ở lớp ngoài cùng của nguyên tử Na
Số electron ở lớp ngoài cùng của nguyên tử Cl =7
Số electron ở lớp ngoài cùng của ion Cl- =8
=>Số electron ở lớp ngoài cùng của ion Cl- nhiều hơn số electron ở lớp ngoài cùng của nguyên tử Cl
Số electron lớp ngoài cùng của `Na` bé hơn ion `Na^+`
Số electron lớp ngoài cùng của `Cl` bé hơn ion `Cl^-`

tham khảo
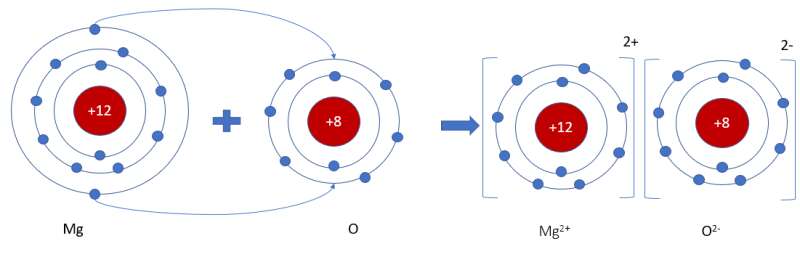
- Nguyên tử Mg (có số hiệu nguyên tử = 12) nhường 2 electron cho O, tạo thành ion Mg2+
- Nguyên tử O (có số hiệu nguyên tử = 8) nhận 2 electron từ Mg, tạo thành ion O2-
=> Ion dương Mg2+ và ion âm O2- mang điện tích trái dấu nên hút nhau, tạo thành liên kết ion
- Sơ đồ mô tả quá trình tạo thành liên kết ion trong phân tử hợp chất magnesium oxide:

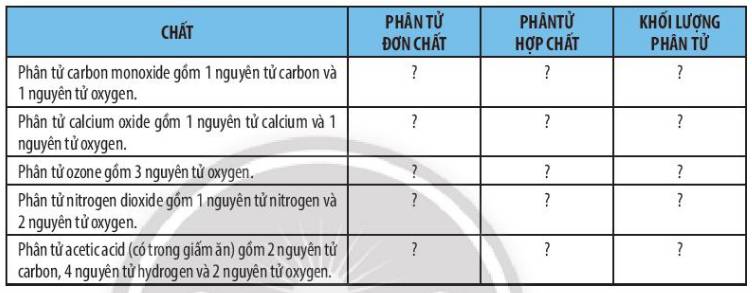
| Chất | Phân tử đơn chất | Phân tử hợp chất | Khối lượng phân tử |
| Phân tử carbon monoxide gồm 1 nguyên tử carbon và 1 nguyên tử oxygen | S | Đ | 28 |
| Phân tử calcium oxide gồm 1 nguyên tử calcium và 1 nguyên tử oxygen | S | Đ | 56 |
| Phân tử ozone gồm 3 nguyên tử oxygen | Đ | S | 48 |
| Phân tử nitrogen dioxide gồm 1 nguyên tử nitrogen và 2 nguyên tử oxygen | S | Đ | 46 |
| Phân tử acetic acid (có trong giấm ăn) gồm 2 nguyên tử carbon, 4 nguyên tử hydrogen và 2 nguyên tử oxygen | S | Đ | 60 |

| Tập tính(1) | Bẩm sinh (2) | Học dược (3) | Ý nghĩa (4) |
| Giăng tơ của nhện | + | - | |
| Bú mẹ của chó con | + | - | |
| Rình con mồi của mèo | - | + | |
Vào mùa sinh sản, ếch đực kêu vang để thu hút bạn tình
| + | - |
Bổ sung thêm:
Tuân thủ luật giao thông của con người
Về bẩm sinh đánh dấu -
Về học dược dánh dấu +

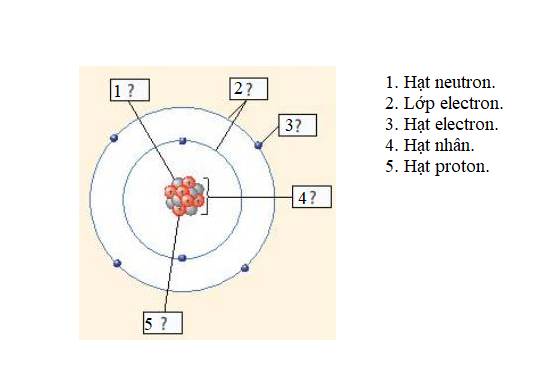
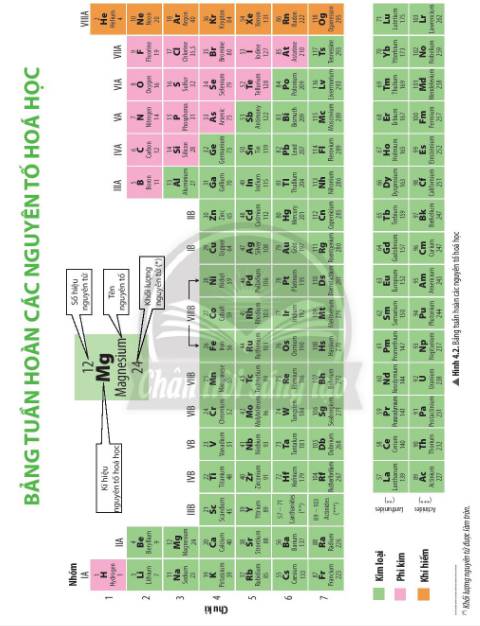
Dựa vào Hình 4.2, bảng tuần hoàn được cấu tạo gồm các ô nguyên tố được sắp xếp thành các hàng và cột.
- Các ô nguyên tố được sắp xếp lần lượt theo chiều điện tích hạt nhân tăng dần.
- Các nguyên tố hóa học có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
- Các nguyên tố có số electron lớp ngoài cùng bằng nhau được xếp thành một cột.
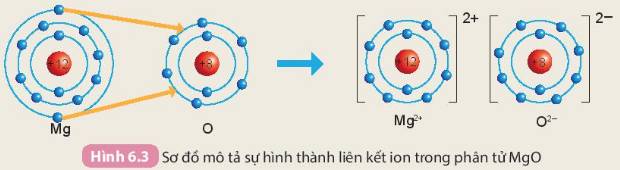

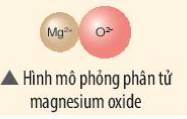

Khi hình thành phân tử `MgO,` các nguyên tử đã có sự nhường nhận `e` như sau:
`-` Nguyên tử `Mg` nhường `2e` ở lớp ngoài cùng cho nguyên tử `O` để tạo thành ion dương \(Mg^{2+}\) có vỏ bền vững giống khí hiếm `Ne`.
`-` Nguyên tử `O` nhận `2e` vào lớp ngoài cùng từ nguyên tử `Mg` để tạo thành ion âm \(O^{2-}\) có vỏ bền vừng giống khí hiếm `Ne`.
Hai ion trái dấu hút nhau, hình thành nên liên kết ion trong phân tử `MgO`.