Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

400ml = 0,4l
\(n_{HCl}=1.0,4=0,4\left(mol\right)\)
a) Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
0,2 0,4 0,2
b) \(n_{Fe}=\dfrac{0,4.1}{2}=0,2\left(mol\right)\)
⇒ \(m_{Fe}=0,2.56=11,2\left(g\right)\)
\(n_{H2}=\dfrac{0,4.1}{2}=0,2\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,2.22,4=4,48\left(l\right)\)
c) \(n_{CuO}=\dfrac{24}{80}=0,3\left(mol\right)\)
Pt ; \(H_2+CuO\underrightarrow{t^o}Cu+H_2O|\)
1 1 1 1
0,2 0,3 0,2
Lập tỉ số so sánh : \(\dfrac{0,2}{1}< \dfrac{0,3}{1}\)
⇒ H2 phản ứng hết , CuO dư
⇒ Tính toán dựa vào số mol của H2
\(n_{Cu}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{Cu}=0,2.64=12,8\left(g\right)\)
Chúc bạn học tốt
Em coi làm mấy bài hôm nay chưa làm nha, làm được nhiêu làm nè

\(n_{Fe}=\dfrac{m}{M}=\dfrac{8,4}{56}=0,15mol\)
PTHH: Fe + 2HCl \(\rightarrow\) FeCl2 + H2
TL: 1 2 1 1
mol: 0,15 \(\rightarrow\) 0,3 \(\rightarrow\) 0,15 \(\rightarrow\) 0,15
Đổi \(100ml=0,1l\)
\(b.C_{M_{ddHCl}}=\dfrac{n}{V_{dd}}=\dfrac{0,3}{0,1}=3M\)
\(c.V_{H_2}=n.22,4=0,15.22,4=33,6l\)
d. Ta có: \(n_{H_2}=0,15mol\)
PTHH: H2 + CuO \(\rightarrow\) Cu + H2O
TL: 1 1 1 1
mol: 0,15 \(\rightarrow\) 0,15 \(\rightarrow\) 0,15 \(\rightarrow\) 0,15
\(n_{CuO}=\dfrac{m}{M}=\dfrac{20}{80}=0,25mol\)
Lập tỉ lệ: \(\dfrac{n_{H_2}}{1}:\dfrac{n_{CuO}}{1}\)
\(\Leftrightarrow=\dfrac{0,15}{1}< \dfrac{0,25}{1}\)
\(\Rightarrow\) H2 hết, CuO dư \(\Rightarrow\) Tính theo H2
\(m_{CuO}=n.M=0,15.64=9,6g\)

a) \(n_{HCl}=0,4.1=0,4\left(mol\right)\)
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: 0,2 0,4 0,2
b, \(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
\(m_{Fe}=0,2.56=11,2\left(g\right)\)
c, \(n_{Cu\left(tt\right)}=\dfrac{10,24}{64}=0,16\left(mol\right)\)
PTHH: H2 + CuO → Cu + H2O
Mol: 0,2 0,2
\(\Rightarrow H=\dfrac{n_{Cu\left(tt\right)}}{n_{Cu\left(lt\right)}}=\dfrac{0,16}{0,2}.100\%=80\%\)

a, PT: \(Mg+H_2SO_{4\left(l\right)}\rightarrow MgSO_4+H_2\)
Ta có: \(n_{Mg}=\dfrac{12}{24}=0,5\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Mg}=0,5\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,5.22,4=11,2\left(l\right)\)
b, PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Theo PT: \(n_{Cu}=n_{H_2}=0,5\left(mol\right)\)
\(\Rightarrow m_{Cu}=0,5.64=32\left(g\right)\)
Bạn tham khảo nhé!

Chỉ có Zn phản ứng thôi. Cu không phản ứng, không tan.---->Chất rắn không tan là Cu
Zn+ H2SO4 ---> ZnSO4+ H2↑
0.1 0.1
nH2= 2.24: 22.4=0.1 mol
mZn= 0.1x65=6.5 g
mCu=10.5-6,5=4 g
%Zn=6.5:10.5x100%=61.9%
%Cu=4:10.5x100%=38.1%

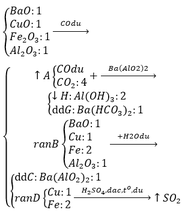
Phương trình:
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
FeSO4 + 2NaOH → Na2SO4 + Fe(OH)2↓
Fe2(SO4)3 + 6NaOH → 3Na2SO4 + 2Fe(OH)3↓
2Fe(OH)2 + ½ O2 → Fe2O3 + 2H2O
2Fe(OH)3 → Fe2O3 + 3H2O
Fe2O3 + 3CO → 2Fe + 3CO2↑
CO2 + Ca(OH)2 → CaCO3↓ + H2O
3CO2 + Ca(OH)2 → Ca(HCO3)2
Ca(HCO3)2 → CaCO3 + CO2↑ + H2O

a, Mg + 2HCl \(\rightarrow\) MgCl2 + H2 Cu + 2HCl \(\rightarrow\) CuCl2 + H2
b, \(\left\{{}\begin{matrix}n_{Mg}=x\\n_{Cu}=y\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}24x+64y=16\\x+y=\dfrac{2,24}{22,4}\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=-0,24\\y=0,34\end{matrix}\right.\)
Xem lại đầu bài nha

a,\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH: Fe + H2SO4 → FeSO4 + H2
Mol: 0,1 0,1 0,1 0,1
b,\(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c,\(C_{M_{ddH_2SO_4}}=\dfrac{0,1}{0,2}=0,5M\)
d,\(C_{M_{ddFeSO_4}}=\dfrac{0,1}{0,2}=0,5M\)

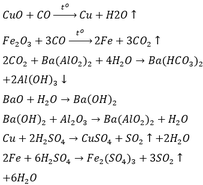
a) \(n_{H_2}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH: Fe + H2SO4 ---> FeSO4 + H2
0,1------------------------------->0,1
b) VH2 = 0,1.22,4 = 2,24 (l)
c) \(n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
LTL: 0,15 > 0,1 => CuO dư
Theo pthh: nCu = nH2 = 0,1 (mol)
=> mCu = 0,1.64 = 6,4 (g)