Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Ta có: n B a C O 3 = 0 , 05 m o l suy ra số mol CO2 trong Z là 0,05 mol tức O bị khử 0,05 mol.
Gọi số mol Fe3O4 và CuO lần lượt là a, b => 232a+80b= 25,4
Cho Y tác dụng với 1,2 mol HNO3 thu được khí 0,175 mol khí NO2.
Bảo toàn N: n N O 3 - t r o n g Y = 1 , 2 - 0 , 175 = 1 , 025 m o l = n N a O H → V = 1 , 025
Ta có 2 TH xảy ra:
TH1: HNO3 dư
a+0,05.2=0,175 =>a=0,075=> b= 0,1 → % F e 3 O 4 = 68 , 5 %
TH2: HNO3 hết
8a+2b-0,05.2+0,175.3= 1,025 nghiệm âm loại.

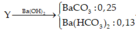
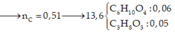
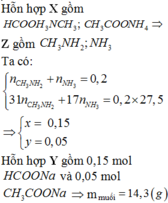







B, 62,57%
Bài này chia làm 2 trường hợp:
TH1: Nếu X và Y đều tạo kết tủa với Ag thì khối lượng tăng lên = mAg - mNa = (108-23)x = 33,44 - 22,44 = 11 . Vậy x = 0,129 mol (số mol hh ban đầu).
Gọi công thức trung bình 2 muối ban đầu là: NaM, ta có: 23 + M = 22,44/0,129 = 173,95 hay M = 150,95. Không có 2 halogen phù hợp.
TH2: Giả sử AgX không kết tủa, suy ra X là F, còn Y là Cl (vì X, Y ở 2 chu kì liên tiếp).
Số mol NaY = số mol NaCl = số mol AgCl = 33,44/143,5 = 0,233 mol.
Vậy %NaF = (22,44 - 58,5.0,233)/22,44 = 39,25%