Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 2: Hòa tan 6,2 gam natri oxit vào 193,8 gam nước được dung dịch A. Cho A tác dụng với 300 gam dung dịch CuSO4 16%. Lọc kết tủa, rửa sạch, đem nung đến khối lượng không đổi, thu được m gam chất rắn màu đen. Giá trị của m là:
A. 29,4 gam B. 14,7 gam C. 9,8 gam D. 19,6 gam
giải thích
Na2O+H2O→2NaOH
0,1____ 0,1____0,2
2NaOH+CuSO4->Na2SO4+Cu(OH)2
0,2______ 0,1______ 0,1_____0,1
.mCu(OH)2=0,1.98=9,8(g)
câu 4
Câu 4: Để trung hoà 200ml hỗn hợp chứa HCl 0,3M và H2SO4 0,1M cần dùng V (ml) dung dịch Ba(OH)2 0,2M. Giá trị của V là: A. 250 ml B. 400 ml C. 350 ml D. 300ml
giải thích
Ba(OH)2 + 2HCl →→BaCl2 + 2H2O (1)
Ba(OH)2 + H2SO4 →→BaSO4 + 2H2O (2)
nHCl=0,2.0,3=0,06(mol)
nH2SO4=0,2.0,1=0,02(mol)
Theo PTHH 1 và 2 ta có:
1212nHCl=nBa(OH)2=0,03(mol)
nBa(OH)2=nH2SO4=0,02(mol)
∑nBa(OH)2=0,03+0,02=0,05(mol)
V dd Ba(OH)2=0,05\0,2=0,25(lít)

nHCl = 0,4.0,5 = 0,2 mol; nH2SO4 = 0,08.0,5 = 0,04 mol
nH+ = nHCl + 2nH2SO4 = 0,28 mol
Đặt số mol của Zn và Mg trong hỗn hợp ban đầu là x và y (mol)
Ta có: 65x + 24y = 5,34 (1)
Zn + 2H+ → Zn2+ + H2
x → 2x → x (mol)
Mg + 2H+ → Mg2+ + H2
y → 2y → y (mol)
Dung dịch Y gồm có:
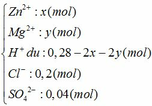
Ta thấy: nH+ + 2nZn2+ + 2nMg2+ (= 0,28 mol) < nNaOH (= 0,3 mol)
=> NaOH dư, Zn(OH)2 bị tan một phần
=> nNaOH hòa tan kết tủa = 0,3 – 0,28 = 0,02 mol
H+ + OH- → H2O
0,28-2x-2y → 0,28-2x-2y (mol)
Zn2+ + 2OH- → Zn(OH)2
x → 2x → x (mol)
Mg2+ + 2OH- → Mg(OH)2
y → 2y → y (mol)
Zn(OH)2 + 2OH- → ZnO22- + H2O
0,01 ← 0,02 (mol)
Khối lượng kết tủa thu được sau phản ứng: m kết tủa = mMg(OH)2 + mZn(OH)2
=> 99(x-0,01) + 58y = 8,43 <=> 99x + 58y = 9,42 (2)
Từ (1) và (2) ta có:

Ta có: nKOH : nBa(OH)2 = 0,4:0,05 = 8
Giả sử số mol của KOH và Ba(OH)2 lần lượt là 8a và a (mol)
=> nBa2+ = a (mol); nOH- = nKOH + 2nBa(OH)2 = 10a (mol)
- Khi kết tủa Mg(OH)2 và Zn(OH)2 đạt giá trị lớn nhất: nOH- = nH+ dư + 2nZn2+ + 2nMg2+
=> 10a = 0,04 + 2.0,06 + 2.0,06 => a = 0,028 mol
Ta thấy a < nSO42- => BaSO4 chưa đạt cực đại
- Giả sử sau khi Mg(OH)2 và Zn(OH)2 đạt cực đại ta thêm 8b mol KOH và b mol Ba(OH)2:
+ Lượng kết tủa sinh thêm là lượng BaSO4: nBaSO4 = nBa(OH)2 = b mol
=> mBaSO4 = 233b (gam)
+ Lượng kết tủa bị tan ra: nZn(OH)2 = nOH-: 2 = 10b : 2 = 5b (mol)
=> mZn(OH)2 = 99.5b = 495b (gam)
Ta thấy khối lượng kết tủa sinh ra nhỏ hơn khối lượng kết tủa bị tan nên khối lượng kết tủa lớn nhất là thời điểm Mg(OH)2 và Zn(OH)2 đạt cực đại. Khi đó: nBa(OH)2 = a = 0,028 mol
=> V = 0,028 : 0,05 = 0,56 (lít)
Kết tủa sau phản ứng gồm có:
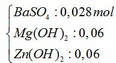
Mg(OH)2 → t ∘ MgO + H2O
0,06 mol → 0,06 mol
Zn(OH)2 → t ∘ ZnO + H2O
0,06 mol → 0,06 mol
=> m = mBaSO4 + mMgO + mZnO = 0,028.233 + 0,06.40 + 0,06.81 = 13,784 gam

Fe+2HCl--->FeCl2+H2 (1)
Fe2O3+6HCl-->2FeCl3+3H2O (2)
FeCl2+2NaOH-->Fe(OH)2+NaCl (3)
FeCl3+3NaOH-->Fe(OH)3+3NaCl (4)
4Fe(OH)2+O2-->2Fe2O3+4H2O (5)
2Fe(OH)3-->Fe2O3+3H2O (6) nH2=0,1mol-->nFe(1)=0,1mol-->mFe(1)=5,6g
nFe=0,1mol-->nFe2O3 tạo ra bởi Fe ban đầu là
0,05mol
-->mFe2O3=8g
-->mFe2O3(6)=16g
-->nFe2O3 ban đầu là 0,1mol -->mhh=5,6+16=21,6g
Ta thấy chỉ có Fe tác dụng với HCl tạo ra khí H 2 nên số mol H 2=0,1 (mol) >n Fe = 0,1(mol)>>mFe =5,6
Ta thấy khối lượng chất rắn là Fe2O3 và bằng 24 >a=29,6

Pt:
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
0,1 → 0,4 0,1 0,1
Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
0,1 ←0,1 → 0,1 0,2
Rắn B là 0,1 mol Cu → x = 6,4 (g)




Bài giảng học thử
Video không hỗ trỡ trên thiết bị của bạn!
Bài 4. Chất béo (P1) - Hóa học lớp 9 - cô Hương Giang
Video không hỗ trỡ trên thiết bị của bạn!
Chuyên đề 2. Các oxit của cacbon (P2) - Ôn luyện Hóa học lớp 9 - cô Trịnh Mỹ Hạnh
Video không hỗ trỡ trên thiết bị của bạn!
Chuyên đề 9. Tính theo phương trình hóa học (tiết 2 - P1) - Ôn luyện Hóa học lớp 9 - cô Trịnh Mỹ Hạnh
Video không hỗ trỡ trên thiết bị của bạn!
Chuyên đề 4. Bazơ (P1) - Ôn luyện Hóa học lớp 9 - cô Trịnh Mỹ Hạnh
Video không hỗ trỡ trên thiết bị của bạn!
Bài 1. Tính chất của kim loại (P1) - Hóa học lớp 9 - cô Hương Giang

(đốt trong oxi dư => các Kl đều lên số
oxh cao nhất)
ta có: mO=m oxit - m kl =46,4-40=6,4g
=> nO =6.4/16=0,4 mol
bạn để ý O trong oxit khi t/d vs HCl sẽ đi
hết vào trong H2O
=>nH2O=nO=0,4 mol
=> nHCl = 2nH2O=0,8 mol
=> VHCl=0,8/2=0,4(l)=400 ml
=>đáp án A

a, \(2NaOH+CuSO_4\rightarrow Na_2SO_4+Cu\left(OH\right)_2\)
\(Cu\left(OH\right)_2\underrightarrow{t^o}CuO+H_2O\)
b, \(m_{CuSO_4}=250.16\%=40\left(g\right)\Rightarrow n_{CuSO_4}=\dfrac{40}{160}=0,25\left(mol\right)\)
Theo PT: \(n_{CuO}=n_{Cu\left(OH\right)_2}=n_{CuSO_4}=0,25\left(mol\right)\)
\(\Rightarrow a=m_{CuO}=0,25.80=20\left(g\right)\)
c, Ta có: m dd sau pư = m dd NaOH + m dd CuSO4 - mCu(OH)2 = 200 + 250 - 0,25.98 = 425,5 (g)





Bài 2:
\(n_{Na2O}=\frac{6,2}{62}=0,1\left(mol\right)\)
\(Na_2O+H_2O\rightarrow2NaOH\)
0,1_______________0,2
\(n_{CuSO4}=\frac{300.16\%}{160}=0,3\)
\(PTHH:CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\)
Trước_____ 0,3_______0,2________________
Phản ứng__0,1______0,2____________
Sau_______ 0,2____ 0 _________ 0,1
\(Cu\left(OH\right)_2\rightarrow CuO+H_2O\)
0,1 __________0,1
\(\rightarrow m=0,1.80=8\left(g\right)\)
Bài 3:
\(n_{Na2CO3}=\frac{10,6}{160}=0,1\left(mol\right)\)
\(n_{H2SO4}=\frac{150.9,8\%}{98}=0,15\left(mol\right)\)
\(Na_2CO_3+H_2SO_4\rightarrow Na_2SO_4+CO_2+H_2O\)
\(n_{H2SO4_{du}}=0,15-0,1=0,05\left(mol\right)\)
\(n_{CO2}=n_{Na2CO3}=0,1\left(mol\right)\)
\(m_{dd_{spu}}=10,6+150-0,144=156,2\left(g\right)\)
\(C\%_{H2SO4}=\frac{0,05.98}{156,2}.100\%=3,14\%\)
\(C\%_{Na2SO4}=\frac{0,1.142}{156,2}.100\%=9,09\%\)
Bài 4:
\(Ba\left(OH\right)_2+2HCl\rightarrow BaCl_2+2H_2O\left(1\right)\)
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4+2H_2O\left(2\right)\)
Theo ptpu, ta có:
\(n_{Ba\left(OH\right)2\left(1\right)}=\frac{1}{2}n_{HCl}=0,03\left(mol\right)\)
\(n_{Ba\left(OH\right)2\left(2\right)}=n_{H2SO4}=0,02\left(mol\right)\)
\(n_{Ba\left(OH\right)2_{can}}=n_{Ba\left(OH\right)2\left(1\right)}+n_{Ba\left(OH\right)2\left(2\right)}=0,05\left(mol\right)\)
\(\rightarrow V_{Ba\left(OH\right)2_{Can}}=\frac{0,05}{0,2}=0,25l=250\left(ml\right)\)