Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

A + H2SO4 → Hỗn hợp khí ⇒ Fe dư; khí Y gồm: H2 ( x mol) và H2S (y mol)
⇒ x + y = 0,1 mol (1)
Bảo toàn S: nH2S = nFeS = nS = y mol
nFe dư = nH2 = x
Bảo toàn Fe: nFe = nFeS + nFe dư = x + y
mX = 56(x + y ) + 32y = 7,2g (2)
Từ (1)(2) ⇒ x = 0,05 mol; y = 0,05 mol
MY = mY : nY = (0,05.2 + 0,05.34) : 0,1 = 18 ⇒ dY/H2 = 9
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{FeS}=b\left(mol\right)\end{matrix}\right.\left(đk:a,b>0\right)\)
TH1: S dư
Vậy toàn bộ lượng khí sinh ra là H2S
\(d_{Y\text{/}H_2}=d_{H_2S\text{/}H_2}=\dfrac{34}{2}=17\)
TH2: Fe dư
\(n_{khí}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Bảo toàn KL: \(m_A=m_X=7,2\left(g\right)\)
PTHH:
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a----------------------------->a
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\)
b-------------------------------->b
Ta có hệ phương trình: \(\left\{{}\begin{matrix}56a+88b=7,2\\a+b=0,1\end{matrix}\right.\)
\(\Leftrightarrow a=b=0,05\left(TM\right)\)
\(M_Y=\dfrac{0,05.\left(2+34\right)}{0,1}=18\left(g\text{/}mol\right)\\ \rightarrow d_{Y\text{/}H_2}=\dfrac{18}{2}=9\)

\(Fe+S\underrightarrow{^{to}}FeS\)
Ta có:
\(n_{Fe}=\frac{5,6}{56}=0,1\left(mol\right)\)
\(n_S=\frac{3,2}{32}=0,1\left(mol\right)\)
Vì số mol hai chất bằng nhau theo đúng tỉ lệ phản ứng nên tính hiệu suất theo chất nào cũng được.
Gọi số mol Fe phản ứng là x
\(\Rightarrow n_{FeS}=n_{Fe\left(pư\right)}=x\left(mol\right);n_{Fe\left(dư\right)}=0,1-x\left(mol\right)\)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(\Rightarrow n_{H2S}=n_{FeS}=x\left(mol\right),n_{H2}=n_{Fe\left(dư\right)}=0,1-x\left(mol\right)\)
\(\Rightarrow n_Y=x+0,1-x=0,1\left(mol\right)\)
\(\Rightarrow m_Y=34.x+2\left(0,1-x\right)=0,1.10,6.2\)
\(\Rightarrow x=0,06\left(mol\right)\)
\(\Rightarrow H=\frac{0,06}{0,1}=60\%\)

Theo đề bài, sắt còn dư sau khi phản ứng với lưu huỳnh
PTHH: \(Fe+S\underrightarrow{t^o}FeS\) (1)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\) (2)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\) (3)
Ta có: \(n_{hhkhí}=\dfrac{2,688}{22,4}=0,12\left(mol\right)=n_{Fe\left(3\right)}+n_{FeS}=\Sigma n_{Fe}\)
\(\Rightarrow m_{Fe}=0,12\cdot56=6,72\left(g\right)\)

a) Hỗn hợp A gồm FeS (x mol), Fe dư (y mol) và S dư (0,8 gam)
FeS + 2HCl -------> FeCl2 + H2S
x………………..………x…….x (mol)
Fe + 2HCl -------> FeCl2 + H2
y…………………..…y……..y (mol)
=> Khí D gồm H2S và H2
\(M_D=\dfrac{34x+2y}{x+y}=9.2=18\) (*)
Khí D sục rất từ từ qua dung dịch CuCl2
H2S + CuCl2 -------> CuS + 2HCl
x………………………...x (mol)
=>\(n_{CuS}=x=\dfrac{9,6}{96}=0,1\left(mol\right)\)
Từ (*) => y = 0,1 (mol)
nFe = x+ y = 0,1 + 0,1= 0,2 (mol)
=> m = 0,2 .56 = 11,2 (g)
nS pư = x = 0,1 (mol)
=> p = 0,1.32 + 0,8 = 4 (g)
b) Dung dịch C chứa FeCl2
nFeCl2 = x + y = 0,2 (mol)
FeCl2 + 2NaOH -------> Fe(OH)2 + 2NaCl
0,2................................,.0,2 (mol)
4Fe(OH)2 + O2 + 2H2O -------> 4Fe(OH)3
0,2..............................................0,2 (mol)
2Fe(OH)3 ------> Fe2O3 + 3H2O
0,2........................0,1 (mol)
Chất rắn là Fe2O3
Theo PT => nFe2O3 = 0,1 mol
=> mFe2O3 = 0,1.160 = 16 gam

\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\\ n_S=\dfrac{4,8}{32}=0,15\left(mol\right)\)
PTHH: Fe + S --to--> FeS (1)
LTL: \(0,2>0,15\rightarrow\) Fe dư
Theo pthh (1):
\(n_{Fe\left(pư\right)}=n_{FeS}=n_S=0,15\left(mol\right)\\ \rightarrow\left\{{}\begin{matrix}m_{Fe\left(dư\right)}=\left(0,2-0,15\right).56=2,8\left(g\right)\\m_{FeS}=0,15.88=13,2\left(g\right)\end{matrix}\right.\)
PTHH:
FeS + 2HCl ---> FeCl2 + H2S
0,15 0,15
Fe + 2HCl ---> FeCl2 + H2
0,05 0,05
\(\rightarrow M_Z=\dfrac{0,15.34+0,05.2}{0,15+0,05}=26\left(\dfrac{g}{mol}\right)\)
=> dZ/H2 = \(\dfrac{26}{2}=13\)

1.Chi tiết câu hỏi: Nung hỗn hợp X gồm Zn và S ở nhiệt độ cao thu đư | BigSchool.vn
2.
Câu 2: Nung hỗn hợp gồm 5,6 gam bột Fe và 4,0 gam bột S ở nhiệt độ cao thu được chất rắn X. Cho X vào dung dịch HCl dư, khí thoát ra có tỷ khối so với H2 là 13,8 . Vậy hiệu suất của phản ứng giữa sắt và lưu huỳnh là:
A. 65% B. 80% C. 70% D. 75%
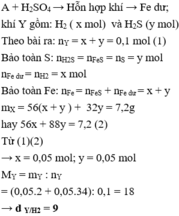
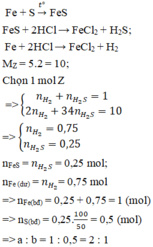
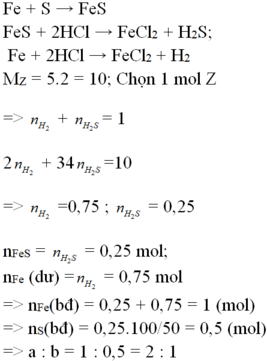
b1
cho m gam hỗn hợp gồm Zn và S vào bình không có không khí ,nung bình sau một thời gian thu được chất
b2
Fe+Sto→FeS
Ta có: nFe=5,6\56=0,1 mol; nS=3,2\32=0,1 moln
VÌ số mol hai chất bằng nhau theo đúng tỉ lệ phản ứng nên tính hiệu suất theo chất nào cũng được.
Gọi số mol Fe phản ứng là x
→nFeS=nFe phản ứng=x mol; nFe dư=0,1−x mol\
FeS+2HCl→FeCl2+H2S\
Fe+2HCl→FeCl2+H2\
→nH2S=nFeS=x mol; nH2=nFe dư=0,1−x mol\
→nY=x+0,1−x=0,1 mol; mY=34.x+2.(0,1−x)=0,1.10,6.2→x=0,06 mol
Hiệu suất phản ứng: H=0,06\0,1=60%