Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: \(m_{b1tang}=m_{H_2O}\Rightarrow n_{H_2O}=\dfrac{0,117}{18}=0,0065\left(mol\right)\)
\(\Rightarrow n_H=2n_{H_2O}=0,013\left(mol\right)\)
\(m_{b2tang}=m_{CO_2}\Rightarrow n_{CO_2}=\dfrac{0,396}{44}=0,009\left(mol\right)\)
\(\Rightarrow n_C=2n_{CO_2}=0,009\left(mol\right)\)
Khi nung 1,35 g A thì thu được: \(n_{N_2}=\dfrac{0,112}{22,4}=0,005\left(mol\right)\)
\(\Rightarrow\) Khi oxi hóa 0,135 g A thì thu được 0,0005 mol N2.
\(\Rightarrow n_N=2n_{N_2}=0,001\left(mol\right)\)
Vì đốt cháy A thu được CO2, H2O và N2 nên A chắc chắn có C, H, N và có thể có O.
Có: mC + mH + mN = 0,009.12 + 0,013.1 + 0,001.14 = 0,135 (g) = mA.
Vậy: A gồm C, H, N.
Giả sử CTPT của A là: CxHyNt (x, y, t nguyên dương).
⇒ x : y : t = 9 : 13 : 1
Vậy: CTĐGN của A là C9H13N.
Bạn tham khảo nhé!

Khối lượng bình (1) tăng 0,63g=> \(m_{H_2O}=0,63\Rightarrow n_{H_2O}=0,035\left(mol\right)\Rightarrow n_H=0,035.2=0,07\left(mol\right)\Rightarrow m_H=0,07\left(g\right)\)
\(m_{CaCO_3}=5\left(g\right)\Rightarrow n_C=n_{CaCO_3}=\dfrac{5}{100}=0,05\left(mol\right)\Rightarrow m_C=0,05.12=0,6\left(g\right)\)
\(\Rightarrow m_O=0,67-0,07-0,6=0\)
Vậy A ko chứa nguyên tố oxi
\(\Rightarrow\%H=\dfrac{0,07}{0,67}=10,45\%\Rightarrow\%C=100\%-10,45\%=89,55\%\)

Đặt lượng C x H y là a mol, lượng C x + 1 H y + 2 là b mol.
Ta có : a + b = 0,05 (1)
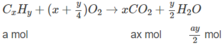
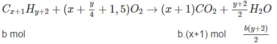
Số mol C O 2 : ax + b(x + 1) = 0,170 (2)
Số mol
H
2
O
: 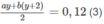
Từ (2) ta có (a + b)x + b = 0,170 ;
b = 0,170 - 0,0500x
b là số mol của một trong hai chất nên 0 < b < 0,0500.
Do đó 0 < 0,170 - 0,0500x < 0,0500 ⇒ 2,40 < x < 3,40 ⇒ x
= 3.
⇒ b = 0,1700 - 0,0500.3 = 0,0200 ⇒ a = 0,0500 - 0,0200 =


Đáp án : B
Từ dữ kiện đề bài ta tính được %H = 7,64% ; %C = 77.37%; %N = 15.05%
=> Công thức phân tử C6H7N

TN1: \(n_{H_2O}=\dfrac{0,117}{18}=0,0065\left(mol\right)\)
\(n_{CO_2}=\dfrac{0,396}{44}=0,009\left(mol\right)\)
Bảo toàn C: nC = 0,009 (mol)
Bảo toàn H: nH = 0,013 (mol)
TN2:\(n_{N_2}=\dfrac{0,112}{22,4}=0,005\left(mol\right)\)
Bảo toàn N: nN = 0,01 (mol)
=> Trong 1,35g A chứa 0,01 mol N
=> Trong 0,135g A chứa 0,001 mol N
=> \(n_O=\dfrac{0,135-12.0,009-1.0,013-0,001.14}{16}=0\left(mol\right)\)
Có: nC : nH : nO = 0,009 : 0,013 : 0,001 = 9:13:1
=> CTHH: (C9H13N)n
=> \(\left\{{}\begin{matrix}\%m_C=\dfrac{12.9n}{135n}.100\%=80\%\\\%m_H=\dfrac{13n}{135n}.100\%=9,63\%\\\%m_N=\dfrac{14n}{135n}.100\%=10,37\%\end{matrix}\right.\)