Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

theo định luật bảo toàn khối lượng: \(mCu+mO_2=mCuO\)
hay 12,8+mO2=14,4
Vây mO2=14,4-12,8=1,6(g)

ban đầu ta có rắn là 12g Cu
sau khi oxi hóa ta có rắn là Cu, CuO , khối lượng rắn này là khối lượng Cu ban đầu cộng với khối lượng O phản ứng
⇒ mO = 14,4 - 12 =2,4 g
nO = 2,4/16 = 0,15 mol
nO = nCuO = 0,15 mol
2Cu + O2 → 2CuO
0,15 ← 0,15
nCu phản ứng = 0,15 ⇒ mCu phản ứng = 0,15.64 =9,6
mCu dư = 12 -9,6 =2,4 g
mCuO = 0,15 .80 =12 g
vậy khối lượng các chất rắn thu được là Cu: 2,4 g, CuO : 12g

80 gam dung dịch A chứa 3,52 gam NaOH
=> 200 gam dung dịch A chứa 3,52.200/80 = 8,8 gam
n NaOH = 8,8/40 = 0,22(mol)
Gọi n Na = a(mol) ; n Na2O = b(mol)
=> 23a + 62b = 6,02(1)
$2Na + 2H_2O \to 2NaOH + H_2$
$Na_2O + H_2O \to 2NaOH$
n NaOH = a + 2b = 0,22(2)
Từ (1)(2) suy ra a= 0,1 ; b = 0,06
n H2 = 0,5a = 0,05(mol)
=> m H2O = 200 + 0,05.2 - 6,02 =194,08(gam)
%m Na = 0,1.23/6,02 .100% = 38,2%
%m Na2O = 100% -38,2% = 61,8%

\(n_{Mg\left(OH\right)_2}=a\left(mol\right)\)
\(n_{Fe\left(OH\right)_3}=b\left(mol\right)\)
\(m_{hh}=58a+107b=16.9\left(g\right)\left(1\right)\)
\(Mg\left(OH\right)_2\underrightarrow{^{^{t^0}}}MgO+H_2O\)
\(a.............a\)
\(2Fe\left(OH\right)_3\underrightarrow{^{^{t^0}}}Fe_2O_3+3H_2O\)
\(b.............\dfrac{b}{2}\)
\(m_{Cr}=40a+160\cdot\dfrac{b}{2}=12.4\left(g\right)\left(1\right)\)
\(\left(1\right),\left(2\right):a=0.07,b=0.12\)
\(\%m_{Mg\left(OH\right)_2}=\dfrac{0.07\cdot40}{16.9}\cdot100\%=16.57\%\)
\(\%m_{Fe\left(OH\right)_3}=83.43\%\)

\(a)n_{KMnO_4} = a; n_{KClO_3} = b\Rightarrow 158a + 122,5b = 99,95(1)\\ 2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2\\ 2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\\ n_{O_2} = 0,5a +1,5b = \dfrac{14,56}{22,4}=0,65(2)\\ (1)(2)\Rightarrow a = 0,4 ; b = 0,3\\ \%m_{KMnO_4} = \dfrac{0,4.158}{99,95}.100\% = 63,23\%\\ \%m_{KClO_3} = 100\%-63,23\% = 36,77\%\)
\(n_{K_2MnO_4} = n_{MnO_2} = 0,5a = 0,2(mol)\\ n_{KClO_3} = b = 0,3(mol)\\ m_{hh\ sau\ pư} = 99,95 - 0,65.32 = 79,15(gam)\\ \%m_{K_2MnO_4} = \dfrac{0,2.197}{79,15}.100\% = 49,78\%\\ \%m_{MnO_2} = \dfrac{0,2.87}{79,15},100\% = 21,98\%\\ \%m_{KCl} = 28,24\%\)

\(n_{O_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH:
\(2Cu+O_2\underrightarrow{t^o}2CuO\)
x..........0,5x.....x
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
y...........\(\dfrac{2y}{3}\).......\(\dfrac{y}{3}\)
Ta có hệ PT: \(\left\{{}\begin{matrix}64x+56y=14,8\\0,5x+\dfrac{2y}{3}=0,15\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,15\end{matrix}\right.\)
b. \(\Rightarrow n_{CuO}=0,1\left(mol\right)\) \(\Rightarrow m_{CuO}=0,1.80=8,1\left(g\right)\)
\(n_{Fe_3O_4}=0,05\left(mol\right)\Rightarrow m_{Fe_3O_4}=0,05.232=11,6\left(g\right)\)
a. \(\Rightarrow m_{hh_{ChatRan}}=8,1+11,6=19,7\left(g\right)\)
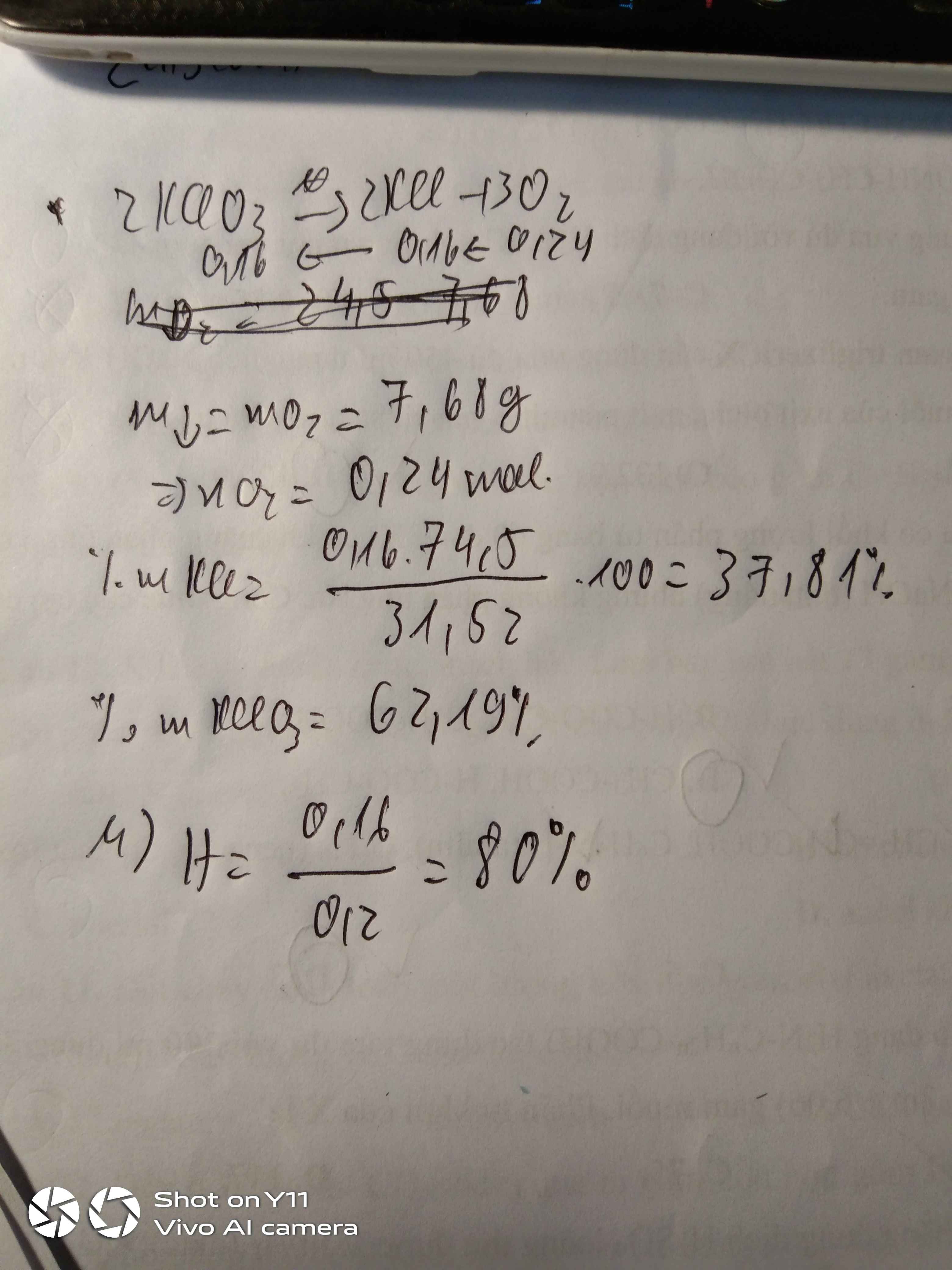
Lời giải:
PTHH: 2Cu + O2 ===> 2CuO
Ta có: nCu = \(\frac{12,8}{64}=0,2\left(mol\right)\)
+) Nếu Cu hết, theo PTHH, nCuO = 0,2 (mol)
=> mCuO = 0,2 x 80 = 16 (gam) > 14,4
=> Giả thiết sai
+) Nếu Cu dư
Đặt số mol Cu phản ứng là a (mol)
=> mCu(phản ứng) = 64a (gam)
=> mCuO(dư) = 12,8 - 64a (gam)
=> nCuO = a (mol)
=> mCuO = 80a (gam)
Mặt khác: mchất rắn = 12,8 - 64a + 80a = 14,4
Giải phương trình, ta được a = 0,1 (gam)
=> mCu(trong hỗn hợp) = 12,8 - 0,1 x 64 = 6,4 (gam)
=> mCuO(trong hỗn hợp) = 14,4 - 6,4 = 8 (gam)
Theo cái đề là biết có Cu dư rồi, còn biện luận ra cũng được
2Cu+O2==> 2CuO
\(n_{Cu}=\frac{12,8}{64}=0,2mol\)
Đặt số mol Cu pứ là x=> số mol dư là 0,2-x
Ta có: \(m_{Cu\left(dư\right)}+m_{CuO}=m_{cr}\)
\(\left(0,2-x\right)64+80x=14,4\)
\(\Rightarrow x=0,1\left(mol\right)\)
\(n_{CuO}=n_{Cu}=0,1mol\)
\(m_{CuO}=0,1.80=8g\)
\(m_{Cu\left(dư\right)}=14,4-8=6,4g\)