Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Khí H2S và axit sunfuric đặc tham gia các phản ứng oxi hóa – khử thì khí H2S chỉ thể hiện tính khử và H2SO4 đặc chỉ thể hiện tính oxi hóa. Vì trong H2S số oxi hóa của S chỉ có thể tăng, trong H2SO4 số oxi hóa S chỉ có thể giảm.
Vì trong H2S số oxi hóa của S là -2 (là số oxi hóa thấp nhất của S) nên chỉ có thể tăng (chỉ thể hiện tính khử), trong H2SO4 số oxi hóa của S là +6 (là số oxi hóa cao nhất của S) nên chỉ có thể giảm (chỉ thể hiện tính oxi hóa).
b) Phương trình phản ứng hóa học:
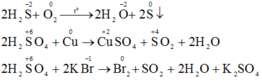

- Theo Hình 10.1 ta thấy:
+ Kim loại Na có 1 electron ở lớp vỏ ngoài cùng => Xu hướng nhường đi 1 electron để đạt cấu hình khí hiếm
+ Phi kim Cl có 7 electron ở lớp vỏ ngoài cùng => Xu hướng nhận thêm 1 electron để đạt cấu hình khí hiếm
=> Cl đã nhận thêm 1 electron từ Na để trở thành các ion
=> Phát biểu (1) phù hợp với sơ đồ phản ứng ở Hình 10.1

Đáp án C
1. Sai: cân bằng hóa học là cân bằng động
2. đúng: phản ứng nghịch thu nhiệt, khi tăng nhiệt độ cân bằng sẽ chuyển về phía làm giảm nhiệt độ (thu nhiệt).
3. đúng
4. đúng
5. sai, nồng độ thay đổi không làm thay đổi hằng số cân bằng. Hằng số cân bằng chỉ thay đổi khi thay đổi nhiệt độ.
6. sai: chỉ tính những chất khí hoặc những chất tan trong dung dịch, nếu là chất rắn thì không được tính.
=> Đáp án C

1. sai: cân bằng hóa học là cân bằng động
2. đúng: phản ứng nghịch thu nhiệt, khi tăng nhiệt độ cân bằng sẽ chuyển về phía làm giảm nhiệt độ (thu nhiệt).
3. đúng
4. đúng
5. sai, nồng độ thay đổi không làm thay đổi hằng số cân bằng. Hằng số cân bằng chỉ thay đổi khi thay đổi nhiệt độ.
6. sai: chỉ tính những chất khí hoặc những chất tan trong dung dịch, nếu là chất rắn thì không được tính.
Đáp án C

Cu Br 2
Cu Br 2 là chất oxi hóa
Cu Br 2 + Fe → Fe Br 2 + Cu
Cu Br 2 là chất khử
Cu Br 2 + Cl 2 → Cu Cl 2 + Br 2

Để chuyển thành anion mang điện tích âm, nguyên tử của các nguyên tố nhóm halogen nhận thêm electron (do có 7 e lớp ngoài cùng).
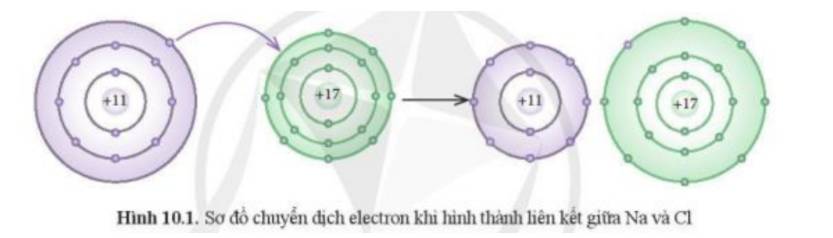

- Cấu hình electron Na (Z = 11): 1s22s22p63s1 => Có 1 electron ở lớp ngoài cùng
=> Xu hướng cho đi 1 electron để đạt cấu hình electron bền vững
=> Dễ dàng tham gia phản ứng hóa học
- Cấu hình electron của Cl (Z = 17): 1s22s22p63s23p5 => Có 7 electron ở lớp ngoài cùng
=> Xu hướng nhận thêm 1 electron để đạt cấu hình electron bền vững
=> Dễ dàng tham gia phản ứng hóa học
- NaCl: Được tạo bởi 2 nguyên tố là Na và Cl. Trong hợp chất này Na sẽ nhường 1 electron và Cl sẽ nhận 1 electron của Na để đạt cấu hình có 8 electron ở lớp vỏ ngoài cùng
=> Cả 2 nguyên tử đều đạt cấu hình electron bền vững
=> NaCl khó tham gia các phản ứng mà có sự nhường hoặc nhận electron