Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
► Cho "từ từ" H+ vào dung dịch hỗn hợp thì phản ứng xảy ra theo thứ tự:
H+ + CO32– → HCO3– || H+ + HCO3– → CO2 + H2O. Chú ý: bắt đầu có khí thoát ra.
||⇒ nH+ = nCO32– = 0,15 mol ⇒ x = 0,15 ÷ 0,1 = 1,5M. Bảo toàn nguyên tố Cacbon:
nNa2CO3 + nKHCO3 = n↓ ⇒ nKHCO3 = 0,1 mol ⇒ y = 0,1 ÷ 0,1 = 1M

Đáp án : D
Khi nhỏ từ từ HCl vào dung dịch muối thì ban đầu axit rất thiếu nên sẽ có phản ứng :
CO32- + H+ -> HCO3-
HCO3- + H+ -> CO2 + H2O
=> nCO2 = nHCl – nNa2CO3 = 0,05 mol
=>VCO2 = 1,12 lit

Đáp án C
Ta có nHCl = 0,2 mol
nNa2CO3 = 0,15 mol
nKHCO3 = 0,1 mol
⇒ nCO2 = ∑nH+ – nCO32–
= 0,2 – 0,15 = 0,05 mol
⇒ VCO2 = 1,12 lít
+ Bảo toàn cacbon ta có
nHCO3– trong Y = 0,15 + 0,1 – 0,05
= 0,2 mol.
⇒ nBaCO3 = nHCO3– trong Y = 0,2 mol
⇒ mBaCO3 = 39,4 gam

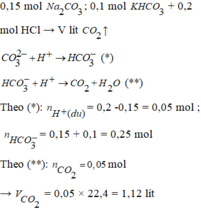

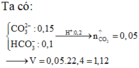

Chọn B
nH+ = 0,2 < 0,15 x 2 + 0,1 → CO2 chưa đạt số mol tối đa
Nhỏ từ từ H+ vào dung dịch hỗn hợp 2 muối thì phản ứng xảy ra đồng thời theo đúng tỉ lệ số mol ban đầu. Ban đầu có nCO32- /nHCO3– =3/2
Đặt số mol phản ứng của CO32- là 3a → Số mol HCO3– phản ứng là 2a
nH+ phản ứng = 2 x 3a + 2a = 0,2 → a = 0,025 → nCO2 = 3a + 2a = 0,125
Vậy V = 0,125 x 22,4 = 2,8.