Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

3Ba(OH)\(_2\)+ Al\(_2\)(SO\(_4\))\(_3\)------> 3 BaSO\(_4\)+ 2Al(OH)\(_3\)
Ta có ;n\(_{Ba\left(OH\right)_2}\)= 0,15.0,1=0,015( mol)
n\(_{Al_2}\left(SO_4\right)_3\)= 0,1.0,1=0,01 (Mol)
=> Ba(OH)\(_2\)hết
Theo PTHH: n\(_{BaSO_4}\)=n\(_{Ba\left(OH\right)_2}\)=0,015 (mol)
m\(_{BaSO_4}\)= 0,015. 233=3,495 (g)
n\(_{Al\left(OH\right)_3}\)= \(\frac{2}{3}\)n\(_{Ba\left(OH\right)_2}\)=0,01 mol
m\(Al\left(OH\right)_3\)= 0,01.78=0,78 g
\(n_{Ba\left(OH\right)_2}=0,1.0,15=0,015\left(mol\right);n_{Al_2\left(SO_4\right)_3}=0,1.0,1=0,01\left(mol\right)\)
\(PTHH:3Ba\left(OH\right)_2+Al_2\left(SO_4\right)_3\rightarrow3BaSO_4\downarrow+2Al\left(OH\right)_3\downarrow\)
(mol) 3 1 3 2
(mol) 0,015 \(5.10^{-3}\) 0,015 0,01
\(TL:\frac{0,015}{3}< \frac{0,01}{1}\rightarrow Al_2\left(SO_4\right)_3.du\)
\(m_{kt}=0,015.233+0,01.79=4,285\left(g\right)\)

Bạn tự viết PTHH nhé.
a)nNaOH=0.025mol
Từ PTHH->nH+p/u với NaOH=nNaOH=2.025mol
Đặt nH2SO4=amol.->nHCl=3amol
->nH+ trong dd=2a+3a=5a mol
->a=0.01
->nHCl=0.03mol;nH2SO4=0.01mol
b)nHCl=0.06mol;nH2SO4=0.02mol
->nH+=0.06+0.02x2=0.1mol
->nOH- có thể p/u=nH+=0.1mol
Đặt VddB=x(l)
->nNaOH=0.2xmol;nBa(OH)2=xmol
->nOH-=0.2x+2x=2.2xmol
->x=0.025(l)
c)Áp dụng DLBTKL
->m muối=m axit +m bazo -m H2O
n H2O=1/2 nH+=0.05mol<=>0.9g
->m muối=0.06x36.5+0.02x98+0.2x0.025x40+
0.025x171-0.9=7.725g
Mình nghĩ chắc là đúng rồi đó.

Ba(OH)2 + H2SO4 -> BaSO4 + 2H2O
0,08 -> 0,08
Ta có : 100ml = 0,1 lít
nBa(OH)2 = 0,1.1 = 0,1 (mol)
nH2SO4 = 0,1.0,8 = 0,08 (mol)
Ta có tỉ lệ : \(\frac{nBa\left(OH\right)2}{1}>\frac{nH2SO4}{1}\) (\(\frac{0,1}{1}>\frac{0,08}{1}\))
=> Ba(OH)2 dư, H2SO4 phản ứng hết
mBaSO4 = 0,08.233=18,64 (g)

PTHH: \(2Fe+6H_2SO_4\left(đăc\right)\underrightarrow{t^o}Fe_2\left(SO4\right)_3+3SO_2+6H_2O\)
nFe = 5,6 / 56 = 0,1 (mol)
=> nSO2 = 0,15 (mol)
nNaOH = 0,1 x 0,1 = 0,01 (mol)
=> nOH- = 0,01 (mol)
nBa(OH)2 = 1,2 x 0,1 = 0,12 (mol)
=> nOH- = 0,24 (mol)
=> \(\sum n_{OH^-}=0,24+0,01=0,25\left(mol\right)\)
Ta có: \(1< \frac{n_{OH^-}}{n_{SO2}}< 2\)
=> Phản ứng tạo 2 muối.
Ta có phương trình ion sau:
SO22- + 2OH- ===> SO32- + H2O (1)
a...............2a
SO22- + OH- ===> HSO3- (2)
b..............b
Đặt nSO2 ở phản ứng (1), (2) lần lượt là a, b
Ta có hệ phương trình:
\(\begin{cases}a+b=0,15\\2a+b=0,25\end{cases}\)
\(\Rightarrow\begin{cases}a=0,1\\b=0,05\end{cases}\)
Lượng kết tủa là BaCO3
=> m = 0,1 x 217 = 21,7 gam

\(n_{CO2}=0,2\left(mol\right)\)
\(Ba\left(OH\right)_2+CO_2\rightarrow BaCO_3+H_2O\)
x_________x_______x______________
Dư 0,2 - x mol CO2
\(BaCO_3+CO_2+H_2O\rightarrow Ba\left(HCO_3\right)_2\)
0,2 - x___0,2 - x_______________0,2 - x
Ta có :
\(0,2-x=x\Rightarrow x=0,1\)
0,1 0,1 0,2 CO2 n kết tủa
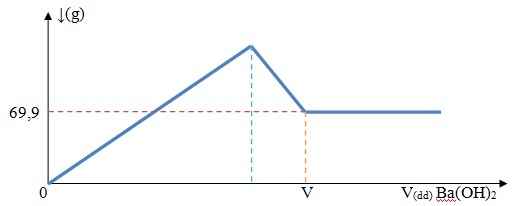

3Ba(OH)2 + Al2(SO4)3 → 2Al(OH)3 + 3BaSO4↓ (1)
2Al(OH)3 + Ba(OH)2 → Ba(AlO2)2 + 4H2O (2)
Kết tủa có thể là BaSO4 và Al(OH)3
Tại điểm V, khi thêm Ba(OH)2 thì lượng kết tủa vẫn không đổi
=> Kết tủa chỉ còn BaSO4
Ta có : nBaSO4=\(\dfrac{69,9}{233}\)=0,3(mol)
Bảo toàn nguyên tố S : => nAl2(SO4)3.3=nBaSO4.1
=> 0,2.a.3 = 0,3
=> a= 0,5M
=> nAl2(SO4)3=0,5.0,2=0,1(mol)
Từ PT (1) => nAl(OH)3=2nAl2(SO4)3=0,2(mol)
Tại V, từ PT (1), (2) ta có : nBa(OH)2=3nAl2(SO4)3+\(\dfrac{1}{2}\)nAl(OH)3=0,4(mol)
=> VBa(OH)2=\(\dfrac{0,4}{0,5}\)=0,8(l)