Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giả sử nAgNO3 = 1 mol
2AgNO3 → 2Ag + 2NO2 + O2
1 → 1 1 0,5 (mol)
4NO2 + O2 + 2H2O → 4HNO3
1 → 0,25 1 (mol)
3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O
0,75 ← 1 (mol)
⇒%mAg phản ứng = (0,75 ÷ 1).100% = 75%
Đáp án D.

Chọn C
2AgNO3 → t ℃ 2Ag + 2NO2 + O2
x x x (mol)
dd Z: HNO3 x mol
3Ag + 4HNO3 ® 3AgNO3 + NO + 2H2O
Ag dư = x – 3x/4 = 1x/4
ð %m không tan = 25%

Phần O2 sinh ra khi nung đi hết vào kim loại tạo oxit, đó là lý do ta chỉ thu được một khí Z là NO2 (0,4 mol).
Khi nung hỗn hợp T trong không khí thì sản phẩm thu được sẽ gồm các oxit “bão hòa” hóa trị (CuO, Fe2O3).
Số mol electron tối đa mà X có thể cho là: 3nNO =0,54 mol
Như vậy sẽ cần 0,54/2 = 0,27 mol O đưa vào rắn X để thu được 41,6 gam rắn gồm các oxit “bão hòa”.
→mX = mr + mO = 41,6 -0,27.16=37,28 gam
→m =mX = mNO2 = 37,28+46x0,4=55,68 gam
Chọn đáp án A

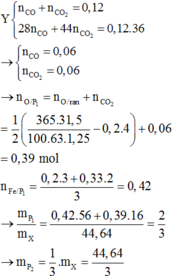


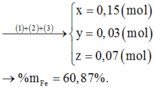

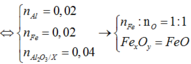
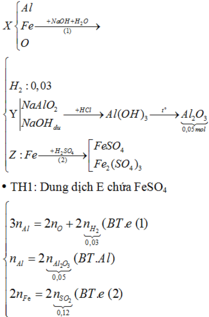

Đáp án D
Chọn 1 mol AgNO3 ban đầu. Có các phản ứng xảy ra như sau:
Nhận xét: Với bài này, các bạn ó thể vận dụng những nhận xét rút ra từ phần Ví dụ minh họa để giải nhanh bài tập như sau: