Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Cho tàn đóm thử các chất:
- Cháy mãnh liệt -> O2
- Cháy yếu -> không khí
- Không cháy -> Có, CO2
Dẫn qua dd Ca(OH)2
- CO2 bị hấp thụ
- CO không bị hấp thụ, lọc lấy
b) Cho thử quỳ tím:
- Chuyển đỏ -> H2SO4
- Chuyển xanh -> Ca(OH)2
- Không đổi màu -> NaCl, Na2SO4
Cho tác dụng với dd BaCl2
- Kết tủa trắng -> Na2SO4
- Không hiện tượng -> NaCl
c) Cho thử quỳ tím:
- Chuyển đỏ -> HNO3, HCl
- Chuyển xanh -> KOH
- Không đổi màu -> MgCl2
Thả Cu vào từng chất:
- HCl không hiện tượng
- HNO3 có phản ứng với Cu

a) Cho thử QT:
- QT chuyển đỏ: H2SO4
- QT chuyển xanh: KOH
- QT chuyển tím: Mg(NO3)2, NaCl (1)
Cho (1) tác dụng với dd AgNO3:
- Có kết tủa màu trắng: NaCl
\(NaCl+AgNO_3\rightarrow AgCl\downarrow+NaNO_3\)
- Không hiện tượng: Mg(NO3)2
b) Cho thử tàn que đóm:
- Que đóm bùng cháy: O2
- Không hiện tượng: CO2, H2, CH4 (1)
Dẫn (1) qua dd Ca(OH)2 dư:
- Có kết tủa màu trắng: CO2
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow+H_2O\)
- Không hiện tượng: H2, CH4 (2)
Dẫn (2) qua Fe2O3 nung nóng:
- Chất rắn đỏ nâu chuyển dần sang màu xám: H2
\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
- Không hiện tượng: CH4

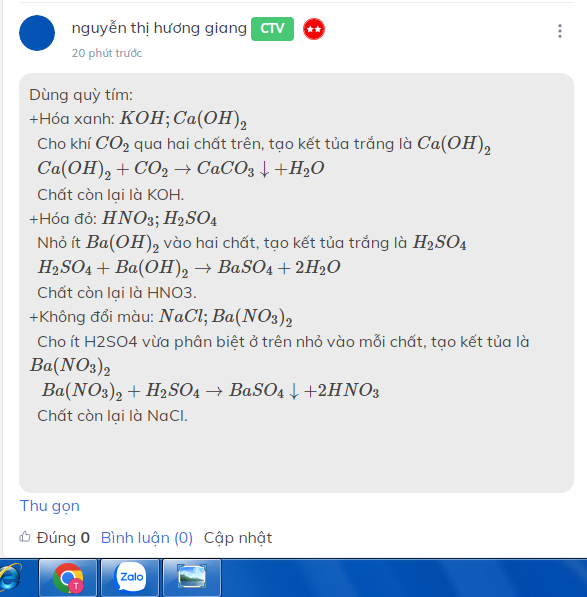
Dùng quỳ tím:
+Hóa xanh: \(KOH;Ca\left(OH\right)_2\)
Cho khí \(CO_2\) qua hai chất trên, tạo kết tủa trắng là \(Ca\left(OH\right)_2\)
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\downarrow+H_2O\)
Chất còn lại là KOH.
+Hóa đỏ: \(HNO_3;H_2SO_4\)
Nhỏ ít \(Ba\left(OH\right)_2\) vào hai chất, tạo kết tủa trắng là \(H_2SO_4\)
\(H_2SO_4+Ba\left(OH\right)_2\rightarrow BaSO_4+2H_2O\)
Chất còn lại là HNO3.
+Không đổi màu: \(NaCl;Ba\left(NO_3\right)_2\)
Cho ít H2SO4 vừa phân biệt ở trên nhỏ vào mỗi chất, tạo kết tủa là \(Ba\left(NO_3\right)_2\)
\(Ba\left(NO_3\right)_2+H_2SO_4\rightarrow BaSO_4\downarrow+2HNO_3\)
Chất còn lại là NaCl.

* Trích một ít các chất làm mẫu thử
a) Cho các dd tác dụng với quỳ tím
+ QT chuyển đỏ: HCl
+ QT chuyển xanh: Ba(OH)2
+ QT không chuyển màu: NaCl
b)
- Cho các dd tác dụng với quỳ tím
+ QT chuyển đỏ: HCl, H2SO4 (1)
+ QT chuyển xanh: Ba(OH)2
+ QT không chuyển màu: NaCl, Na2SO4 (2)
- Cho dd Ba(OH)2 tác dụng với dd ở (1)
+ Không hiện tượng: HCl
\(Ba\left(OH\right)_2+2HCl\rightarrow BaCl_2+2H_2O\)
+ Kết tủa trắng: H2SO4
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4\downarrow+2H_2O\)
- Cho dd Ba(OH)2 tác dụng với dd ở (2)
+ Không hiện tượng: NaCl
+ Kết tủa trắng: Na2SO4
\(Na_2SO_4+Ba\left(OH\right)_2\rightarrow2NaOH+BaSO_4\downarrow\)
c)
- Dẫn các khí đi qua dd Ca(OH)2 dư
+ Kết tủa trắng: CO2
+ Không hiện tượng: O2, H2 (1)
- Cho các khí ở (1) tiếp xúc với que đóm còn tàn đỏ
+ Que đóm bùng cháy: O2
+ Que đóm tắt: H2
d)
- Dẫn các khí đi qua dd Br2 dư
+ Dung dịch nhạt màu dần: SO2
\(SO_2+Br_2+2H_2O\rightarrow2HBr+H_2SO_4\)
+ Không hiện tượng: O2, H2, N2 (1)
- Cho các khí ở (1) tiếp xúc với que đóm còn tàn đỏ
+ Que đóm bùng cháy: O2
+ Que đóm tắt: H2, N2 (2)
- Dẫn các khí ở (2) đi qua bột CuO nung nóng:
+ Không hiện tượng: N2
+ Chất rắn màu đen dần chuyển sang màu đỏ: H2
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
e)
- Hòa tan 3 chất rắn vào nước:
+ Chất rắn không tan: CaCO3
+ Chất rắn tan: CaO, P2O5
\(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
\(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
- Cho dd thu được ở trên tác dụng với quỳ tím
+ QT chuyển đỏ: H3PO4 => Nhận biết được P2O5
+ QT chuyển xanh: Ca(OH)2 => Nhận biết được CaO
f)
- Hòa tan 3 kim loại vào nước:
+ Kim loại tan, có khí thoát ra: Na
\(2Na+2H_2O\rightarrow2NaOH+H_2\)
+ Kim loại không tan: Mg, Fe (1)
- Cho 2 kim loại ở (1) tác dụng với dd HNO3 đặc nguội
+ Kim loại tan, có khí màu nâu thoát ra: Mg
\(Mg+4HNO_3\rightarrow Mg\left(NO_3\right)_2+2NO_2+2H_2O\)
+ Kim loại không tan: Fe
a) Trích mẫu thử. Dùng quỳ tím để thử.
dung dịch làm quỳ tím hoá đỏ --> HCl
dung dịch làm quỳ tím hoá xanh --> Ba(OH)2
dung dịch làm quỳ tím không đổi màu --> NaCl
b) Trích mẫu thử. dùng quỳ tím để thử.
dung dịch làm quỳ tím hoá xanh --> Ba(OH)2
dung dịch làm quỳ tím hoá đỏ --> HCl và H2SO4
Cho 2 dung dịch này tác dụng với BaCl2.
- Có kết tủa --> H2SO4
Pthh: BaCl2 + H2SO4 --> BaSO4 + 2HCl
- không có phản ứng --> HCl
Cho 2 dung dịch còn lại là NaCl và Na2SO4 tác dụng với BaCl2
- có kết tủa --> Na2SO4
Pthh: BaCl2 + Na2SO4 --> BaSO4 + 2NaCl
c) Đốt từng khí. Cháy lửa xanh --> H2
Dẫn 2 khí còn lại qua Ca(OH)2
- có kết tủa --> CO2
Pthh: CO2 + Ca(OH)2 --> CaCO3 + H2O
- không có hiện tượng --> O2

a) Cho thử QT:
- Hoá xanh: KOH
- Hoá đỏ: HCl
- Không chuyển màu: Na2SO4
b) Cho thử QT:
- Hoá xanh: Ba(OH)2
- Hoá đỏ: H3PO4
- Không chuyển màu: BaCl2
c) Cho thử QT:
- Hoá xanh: NaOH
- Hoá đỏ: H2SO4
- Không chuyển màu: NaCl, KNO3 (1)
Cho (1) tác dụng với dd AgNO3:
- Có kết tủa màu trắng: NaCl
\(NaCl+AgNO_3\rightarrow AgCl\downarrow+NaNO_3\)
- Không hiện tượng: KNO3
a.Đưa quỳ tím vào 3 dd:
-HCl: quỳ hóa đỏ
-KOH: quỳ hóa xanh
-Na2SO4: quỳ không chuyển màu
b.Đưa quỳ tím vào 3 dd:
-H3PO4: quỳ hóa đỏ
-Ba(OH)2: quỳ hóa xanh
-BaCl2: quỳ không chuyển màu

a) HCl. NaOH. NaCl
Quỳ tím. : đỏ. Xanh. Ko đổi
Dán nhãn
b) H2SO4. Ba(OH)2. Ca(NO3)2
Quỳ tím. Đỏ. Xanh. Ko đổi
Dán nhãn
c) H2SO4. HCl. NaCl. NaOH
Quỳ tím. Đỏ. Đỏ. Ko đổi. Xanh
Cho hai chất làm quỳ tím hóa đỏ vào BaCl2
Kết tủa trắng là H2SO4, Ko hiện tượng là HCl

a) Hòa tan các chất rắn vào nước có pha sẵn quỳ tím:
+ Chất rắn tan,dd chuyển màu xanh: CaO
CaO + H2O --> Ca(OH)2
+ Chất rắn tan, quỳ tím chuyển đỏ: P2O5
P2O5 + 3H2O --> 2H3PO4
+ Chất rắn không tan: MgO
b)
- Cho các dd tác dụng với giấy quỳ tím:
+ QT chuyển đỏ: HCl
+ QT chuyển xanh: Ba(OH)2
+ QT không chuyển màu: NaCl
c)
- Dẫn các khí qua dd Ca(OH)2 dư:
+ Kết tủa trắng: CO2
Ca(OH)2 + CO2 --> CaCO3 + H2O
+ không hiện tượng: H2, O2 (1)
- Dẫn khí ở (1) qua ống nghiệm đựng bột CuO nung nóng
+ Không hiện tượng: O2
+ Chất rắn màu đen chuyển dần sang màu đỏ, xuất hiện hơi nước: H2
CuO + H2 --to--> Cu + H2O
| CaO | P2O5 | MgO | |
| H2O | tan | tan | Không phản ứng |
| quỳ tím | xanh | đỏ | không phản ứng |

Bài 1: Nhận biết các dung dịch muối sau chỉ bằng dung dịch H2SO4:
H2SO4 + NaCl: Không có phản ứng xảy ra với H2SO4. Dung dịch vẫn trong suốt và không có hiện tượng gì xảy ra.
H2SO4 + BaCl2: Sẽ có kết tủa trắng BaSO4 (sulfat bari) kết tủa xuất hiện. Phản ứng cụ thể là:
H2SO4 + BaCl2 -> BaSO4↓ + 2HCl
H2SO4 + Ba(HSO3)2: Không có phản ứng xảy ra với H2SO4. Dung dịch vẫn trong suốt và không có hiện tượng gì xảy ra.
H2SO4 + Na2CO3: Sẽ có sủi bọt khí CO2 thoát ra và dung dịch trở nên mờ. Phản ứng cụ thể là:
H2SO4 + Na2CO3 -> Na2SO4 + H2O + CO2↑
H2SO4 + K2SO3: Sẽ có sủi bọt khí SO2 thoát ra và dung dịch trở nên mờ. Phản ứng cụ thể là:
H2SO4 + K2SO3 -> K2SO4 + H2O + SO2↑
H2SO4 + Na2S: Sẽ có sủi bọt khí H2S (hydro sulfide) thoát ra và dung dịch trở nên mờ. Phản ứng cụ thể là:
H2SO4 + Na2S -> Na2SO4 + H2S↑
Bài 2: Chất nào tác dụng với dung dịch H2SO4 loãng:
Chất tác động với dung dịch H2SO4 loãng để tạo khí hiđro (H2) sẽ là các chất kim loại. Cụ thể, các chất sau sẽ tác động:
Cu (đồng): Phản ứng sẽ tạo khí hiđro (H2) và ion đồng II (Cu^2+):
Cu + H2SO4 -> CuSO4 + H2↑
MgO (oxit magiê): Phản ứng sẽ tạo magiê sulfat (MgSO4):
MgO + H2SO4 -> MgSO4 + H2O
Mg(OH)2 (hydroxide magiê): Phản ứng sẽ tạo magiê sulfat (MgSO4) và nước:
Mg(OH)2 + H2SO4 -> MgSO4 + 2H2O
Al (nhôm): Phản ứng sẽ tạo khí hiđro (H2) và ion nhôm III (Al^3+):
2Al + 6H2SO4 -> 2Al2(SO4)3 + 6H2↑
Vậy, các chất Cu, MgO, Mg(OH)2, và Al tác động với dung dịch H2SO4 loãng để tạo khí hiđro (H2).
a) Cho thử que đóm còn đang cháy:
- Cháy mãnh liệt hơn: O2
- Cháy màu xanh nhạt: H2
\(H_2+\dfrac{1}{2}O_2\underrightarrow{t^o}H_2O\)
- Vụt tắt: CO2
b) Cho thử QT:
- Hoá xanh: NaOH
- Hoá đỏ: H2SO4
- Không đổi màu: Zn(NO3)2
c) Cho thử QT:
- Hoá đỏ: HNO3
- Hoá xanh: KOH
- Không đổi màu: NaCl, K2SO4 (1)
Cho (1) tác dụng với dd BaCl2:
- Có kết tủa trắng: K2SO4
\(K_2SO_4+BaCl_2\rightarrow BaSO_4\downarrow+2KCl\)
- Không hiện tượng: NaCl