Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2AgNO3 + Cu → Cu(NO3)2 + 2Ag
Phương trình ion thu gọn: Cu + 2Ag+ → Cu2+ + 2Ag↓
AgNO3 là chất oxi hóa, Cu là chất khử.
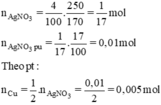
Áp dụng tăng giảm khối lượng

\(n_{AgNO_3}=\dfrac{250.4}{100.170}=\dfrac{1}{17}\left(mol\right)\)
=> \(n_{AgNO_3\left(pư\right)}=\dfrac{1}{17}.17\%=0,01\left(mol\right)\)
PTHH: Cu + 2AgNO3 --> Cu(NO3)2 + 2Ag
____0,005<--0,01--------------------->0,01
=> m = 12 - 0,005.64 + 0,01.108 = 12,76(g)
=> A

Khối lượng của AgNOg trong dung dịch là:
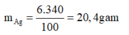
Phương trình phản ứng xảy ra:
![]()
Cứ 1 mol Cu phản ứng với 2 mol AgNO3, sinh ra 1 mol Cu(NO3)2 và 2 mol Ag, khối lượng kim loại tăng
![]()
Khối lượng AgNO3 đã tham gia phản ứng:
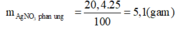
Từ (1)=> Số mol Cu đã phản ứng:
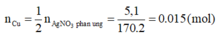
=> Khối lượng của vật sau phản ứng: m = 15 + 152.0,015 = 17,28 (gam).
Đáp án B.

b)
= 10 (gam)
=> phản ứng =
= 0,01 (mol)
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,005 0,01 0,01 (mol)
Khối lượng của vật sau phản ứng là:
10 + 108.0,01 - 64.0,005 = 10,76 (gam)

b)
= 10 (gam)
=> phản ứng =
= 0,01 (mol)
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,005 0,01 0,01 (mol)
Khối lượng của vật sau phản ứng là:
10 + 108.0,01 - 64.0,005 = 10,76 (gam)

\(m_{AgNO_3}=\frac{25.4}{100}=1\left(g\right)\)
Khối lượng giảm là khối lượng phản ứng
=> \(m_{AgNO_3\left(pư\right)}=\frac{1.1,7}{100}=0,017\left(g\right)\)
=> \(n_{AgNO_3\left(pư\right)}=\frac{0,017}{170}=0,0001\left(mol\right)\)
PTHH: \(Cu+2AgNO_3\rightarrow Cu\left(NO_3\right)_2+2Ag\downarrow\)
____0,00005<--0,0001----------------------->0,0001____(mol)
=> m lá đồng sau pư = \(10-0,00005.64+0,0001.108=10,0076\left(g\right)\)

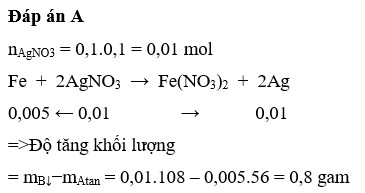
Khối lượng vật sau phản ứng = 10 + 0,01 x 108 – 0,005 x 64 = 10,76 g