Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Giải:
Fe + Cu2+ -> Fe2+ + Cu
Khối lượng Cu bám trên lá Fe là : 64.1,6/(64-56)=12,8g

Chọn đáp án B.
Áp dụng tăng giảm khối lượng có:
n C u = 1 , 6 64 - 56 = 0 , 2 m o l
⇒ m C u = 64 . 0 , 2 = 12 , 8 gam

Đáp án C
Ta cớ pứ: Fe + Cu2+ → Fe2+ + Cu.
Đặt nFepứ = a ⇒ nCu = a.
⇒ mCu – mFe pứ = 0,4 Û 8a = 0,8 Û a = 0,05.
⇒ mFeSO4 = 0,05×152 = 7,6 gam

* Nhận xét: “sau một thời gian phản ứng”, suy ra CuSO4 có thể vẫn còn dư. Gọi số mol Fe phản ứng là x mol.
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
P/ư: x x x x mol
Khối lượng lá sắt tăng = 2,58 - 2,5 = 0,08 gam. Ta có phương trình:
64x - 56x = 0,08
x = 0,01 mol
b) Sô mol CuS04 ban đầu = 0,02625 mol
Trong dung dịch sau phản ứng có hai chất tan là FeSO4 0,01 mol và CuSO4 dư 0,01625 mol.
Khối lượng dung dịch:
mdd = + mFe(p.ư) – mCu = 25.1,12 + 0,01.56 - 0,01.64 = 27,91 g
C%, CuS04 = .100% ≈ 9,32%
C%, FeSO4 = .100% ≈ 5,45%
\(m_{ddCuSO_4}\) = 25.1,12 = 28g\(\Rightarrow m_{CuSO_4}\) = 4,2g\(\Rightarrow n_{CuSO_4}\) = 0,02625mol
Fe + CuSO4\(\rightarrow\) FeSO4 + Cu
x \(\rightarrow\) x-----------------x---------x
\(m_{tăng}\) = 64x-56x = 0,08g \(\Rightarrow\) x=0,01mol
\(n_{Fe\left(bđ\right)}\) = 5/112 mol \(\Rightarrow\) Fe dư, CuSO4 dư ( vì phản ứng ko hoàn toàn)
\(\Rightarrow\)trong dd sau pứ có \(FeSO_4=0,01mol\); \(CuSO_4=0,01625mol\)
mdd = mCuSO4 + mFepư - mCu = mddCuSO4 - \(m_{giảm}\) =28 - 0,08 = 27,92g
\(\Rightarrow\) C% FeSO4 = 0,01(56 + 96).100/ 27,92 = 5,44%
C% CuSO4 = 0,01625.(64 + 96).100/27,92 = 9,31%
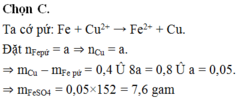
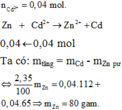
Chọn A.
Fe + Cu2+ → Fe2+ + Cu
x mol x mol
⇒ mlá thép tăng = mCu - mFe
⇔ 1,6 = 64x - 56x ⇒ x = 0,2 mol.
⇒ mCu = 0,2.64 = 12,8 gam.
K liên quan lắm nhưng cho mình hỏi là m(fe) pứ=29,6-12,8 hay m(fe) pứ=56.0,2 🙏🙏🙏