Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Na2CO3 + HCl = NaCl + NaHCO3
KHCO3 + HCl = KCl +CO2 + H2O
n HCl = 0,1 * 1,5=0,15 mol
n CO2 = 1,008 / 22,4 =0,045 mol => n KHCO3 = 0,045 mol = n iôn K+ = n iôn HCO3 -=> nồng độ MOl
dd B tác dụng với Ba(OH)2 dư : Ba(OH)2 (dư) + NaHCO3 = BaCO3 + NaOH +H2O
n kết tủa= n BaCO3 = 29,55/197=0,15 mol => n NaHCO3 = 0,15 mol = nNa2CO3 => n Na + trong ddA = 0,15 *2 = 0,3 mol => nồng độ mol
nHCO3 - = 0,15 mol => nồng độ mol
Có n Na2CO3 và nKHCO3 dễ dàng tính được a(g)
**** Cho từ từ DD A gồm Na2CO3 và NaHCO3 va ddHCl thì sẽ có 2 trường hợp
TH1: Na2CO3 phản ứng trước:
Na2CO3 +2 HCl =2NaCl + H2O +CO2
.................0,15
n Na2CO3 ở câu trên tính dc là 0,15 mol => n HCl phản ứng ở đây là 0,15 * 2 = 0,3 mol

PTHH: Fe + CuSO4 -> FeSO4 + Cu
vậy X là Cu Y là FeSO4 p k bn?


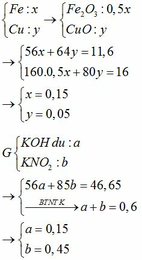
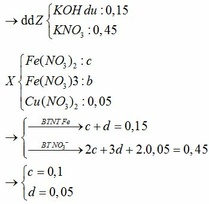

BTKL
mX + mdd HNO3 = mdd X + mH2O + m↑
=> mdd X = 11,6 + 87,5 – 30 . 0,1 – 46 . 0,15 = 89,2g
=> C%Fe(NO3)3 = 13,565%

a) Phương trình phản ứng: Fe + CuSO4 → FeSO4 + Cu b) Số mol của Fe là : 1,96 : 56 = 0,035 (mol) Khối lượng dd CuSO4 là : m ddCuSO4 = 1,12 . 100 = 112 (g) Khối lượng CuSO4 có trong dd là :
mCuSO4 = 10% . 112 = 11,2 (g)
Số mol của CuSO4 là :
11,2 : 160 = 0,07 mol
Fe + CuSO4 ——> FeSO4 + Cu (1)
Theo (1) ta có : nFe = nCuSO4 = 0,07 mol > 0,035 mo
l => số mol của CuSO4 dư
Vậy ta tính theo số mol của Fe.
CM CuSO4 = (0,07 – 0,035/100)*1000 = 0,35 (M)
CM FeSO4 = (0,035/100)*1000 = 0,35 (M)

a) Fe+CuSO4--->FeSO4+Cu(1)
Fe+2HCl--->FeCl2+H2
b)nFe=8,4/56=0,15(mol)
nCuSO4=0,1.1=0,1(mol)
----> Fe dư
chất rắn X là Fe, Cu
dd Y là FeSO4
theo pthh1: nCu=nCuSO4=nFeSO4=0,1(mol)
mCu=a=0,1.64=6,4(g)
c)mddCuSO4=1,08.100=108(g)
mdd sau pứ=108+8,4-6,4=110(g)
⇒ C%FeSO4=0,1.152/110.100≈13,82%

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)

mddCuSO4 = 1,12 x 100 = 112 (g)
mCuSO4 = 10% x 112 = 11,2 (g)
=> nCuSO4 = 11,2 / 160 = 0,07 (mol)
nFe = 1,96 / 56 = 0,035 (mol)
PTHH : Fe + CuSO4 -----> FeSO4 + Cu
Lập tỉ lệ : \(\frac{nFe\left(\text{đề}\right)}{n\left(pt\right)}=\frac{0,035}{1}< \frac{nCuSO_4\left(\text{đề}\right)}{nCuSO_4\left(pt\right)}=\frac{0,07}{1}\)
Vậy CuSO4 dư 0,07 - 0,035 = 0,035 (mol)
=> mCuSO4 (dư) = 0,035 x 160 = 5,6 (g)
b/ Từ pthh suy ra nFeSO4 = 0,035 (mol)
Vì thể tích dung dịch thay đổi không đáng kể nên :
CM = \(\frac{0,035}{0,1}=0,35\left(M\right)\)

\(n_{CuSO_4}=0,1.1=0,1\left(mol\right)\)
\(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right)\)
PTHH: Fe + CuSO4 --> FeSO4 + Cu
Xét tỉ lệ \(\dfrac{0,1}{1}< \dfrac{0,15}{1}\) => CuSO4 hết, Fe dư
PTHH: Fe + CuSO4 --> FeSO4 + Cu
_____0,1<---0,1---------->0,1
Fe + 2HCl --> FeCl2 + H2
0,05------------------->0,05
=> VH2 = 0,05.22,4 = 1,12(l)
b) \(C_{M\left(FeSO_4\right)}=\dfrac{0,1}{0,1}=1M\)