Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nH2=0,1(mol)
PTHH: Mg + 2 HCl -> MgCl2 + H2
0,1__________0,2___________0,1(mol)
MgO + 2 HCl -> MgCl2 + H2O
0,05____0,1___0,05(mol)
mMg=0,1. 24= 2,4(g) -> mMgO=4,4-2,4= 2(g) -> nMgO=0,05((mol)
b) %mMg= (2,4/4,4).100=54,545%
=> %mMgO=45,455%
c) nHCl=0,3(mol) -> mHCl=0,3.36,5=10,95(g)
=> mddHCl=(10,95.100)/7,3=150(g)

a)
$CuO + H_2SO_4 \to CuSO_4 + H_2O$
$ZnO + H_2SO_4 \to ZnSO_4 +H_2O$
b) Gọi $n_{CuO} = a(mol) ; n_{ZnO} = b(mol) \Rightarrow 80a +81b = 12,1(1)$
Theo PTHH :
$n_{H_2SO_4} = a + b = \dfrac{73,5.20\%}{98} = 0,15(mol)(2)$
Từ (1)(2) suy ra : a = 0,05 ; b = 0,1
$\%m_{CuO} = \dfrac{0,05.80}{12,1}.100\% = 33,06\%$
$\%m_{ZnO} = 100\% - 33,06\% = 66,94\%$

a. PTHH:
Fe + 2HCl ---> FeCl2 + H2 (1)
Mg + 2HCl ---> MgCl2 + H2 (2)
b. Gọi x, y lần lượt là số mol của Fe và Mg
Ta có: \(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Theo PT(1): \(n_{H_2}=n_{Fe}=x\left(mol\right)\)
Theo PT(2): \(n_{H_2}=n_{Mg}=y\left(mol\right)\)
\(\Rightarrow x+y=0,25\) (*)
Theo đề, ta lại có: 56x + 24y = 8,25 (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}x+y=0,25\\56x+24y=8,25\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x\approx0,07\\y\approx0,18\end{matrix}\right.\)
=> \(m_{Fe}=0,07.56=3,92\left(g\right)\)
=> \(\%_{m_{Fe}}=\dfrac{3,92}{8,25}.100\%=47,52\%\)
\(\%_{m_{Mg}}=100\%-47,52\%=52,48\%\)

a) nH2=0,2(mol)
PTHH: Mg + 2 HCl -> MgCl2 + H2
0,2______0,4_______0,2_____0,2(mol)
PTHH: MgO +2 HCl -> MgCl2 + H2O
b) mMgO= 8,8 - 0,2.24=4(g)
%mMgO= (4/8,8).100= 45,455%
=>%Mg=54,545%
c) nHCl(tổng)= 2. nMg + 2. nMgO= 2. 0,2+ 0,1.2=0,6(mol)
=> mHCl= 0,6.36,5=21,9(g)
=>mddHCl=(21,9.100)/7,3=300(g)
d) mddMgCl2= mddHCl + m(hỗn hợp ban đầu) - mH2
<=>mddHCl= 300+ 8,8- 0,2.2= 308,4(g)
nMgCl2=0,3(mol) => mMgCl2= 0,3.95=28,5(g)
=>C%ddMgCl2= (28,5/308,4).100=9,241%

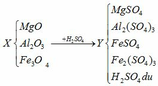
(a) Hòa tan MgO, Al2O3 và Fe3O4 vào H2SO4:
(1) MgO + H2SO4 → MgSO4 + H2O
(2) Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
(3) Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
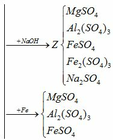
Trung hòa Y:
(4) H2SO4 + 2NaOH → Na2SO4 + 2H2O
Cho dung dịch Y (MgSO4, Al2(SO4)3, FeSO4, Fe2(SO4)3, H2SO4) qua cột chứa bột sắt:
(5) H2SO4 + Fe → FeSO4 + H2
(6) Fe2(SO4)3 + Fe → 3FeSO4
(b) nH2SO4 = 0,45.1 = 0,45 mol
Gọi số mol của MgO, Al2O3 và Fe3O4 trong hỗn hợp ban đầu lần lượt là x, y, z (mol)
Ta có: 40x + 102y + 232z = 20,68 (*)
- Khi hòa tan hỗn hợp vào H2SO4:
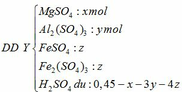
- Trung hòa ¼ dung dịch Y cần 0,025 mol NaOH vậy trung hòa Y cần 0,1 mol NaOH:
Theo PTHH (4): nH2SO4 dư = 0,5nNaOH = 0,05 mol
=> 0,45 – x – 3y – 4z = 0,05
=> x + 3y + 4z = 0,4 (**)
Dung dịch thu được chứa các chất:
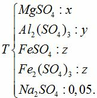
- Giả sử dẫn toàn bộ dung dịch Y qua cột chứa bột Fe:
(5) H2SO4 + Fe → FeSO4 + H2
0,05 → 0,05 (mol)
(6) Fe2(SO4)3 + Fe → 3FeSO4
z → 3z (mol)
Dung dịch sau chứa các chất tan:
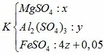
Theo đề bài ta có: mK – mT = 4.1,105
=> [120x + 342y + 152(4z + 0,05)] – [120x + 342y + 152.z + 400z + 0,05.142] = 4,42
=> z = 0,07 (***)
Từ (*) (**) (***) ta giải được z = 0,06; y = 0,02; z = 0,07
Số mol của nguyên tố O trong hỗn hợp X:
nO = nMgO + 3nAl2O3 + 4nFe3O4 = 0,06 + 3.0,02 + 4.0,07 = 0,4 mol
Khối lượng của O: mO = 0,4.16 = 6,4 (gam)
Phần trăm khối lượng của nguyên tố O:


CuO +2HCl= CuCl2 +H2O
ZnO+2HCl= ZnCl2 +H2O
gọi x,y là mol của CuO, ZnO
80x + 81y = 12.1
2x+2y = 0.3
=> x=0.05 , y=0.1 => mCuO= 4 %CuO=4/12.1 m ZnO=8.1 =>%ZnO=8.1/12.1
nH2SO4=1/2nHCl=0.3/2 =0.15
mH2SO4=0.15x98=14.7g => mddH2SO4=14.7/20%=73.5g

\(n_{CO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ a,PTHH:MgCO_3+H_2SO_4\rightarrow MgSO_4+H_2O+CO_2\uparrow\\ MgO+H_2SO_4\rightarrow MgSO_4+H_2O\\ \Rightarrow n_{MgCO_3}=n_{CO_2}=0,1\left(mol\right)\\ \Rightarrow m_{MgCO_3}=0,1\cdot84=8,4\left(g\right)\\ \Rightarrow\%_{MgCO_3}=\dfrac{8,4}{10,4}\cdot100\%\approx80,77\%\\ \Rightarrow\%_{MgO}=100\%-80,77\%=19,23\%\)
\(b,m_{MgO}=10,4-8,4=2\left(g\right)\\ \Rightarrow n_{MgO}=\dfrac{2}{40}=0,05\left(mol\right)\\ \Rightarrow\sum n_{H_2SO_4}=n_{MgCO_3}+n_{MgO}=0,15\left(mol\right)\\ \Rightarrow\sum m_{H_2SO_4}=0,15\cdot98=14,7\left(g\right)\\ \Rightarrow\sum m_{dd_{H_2SO_4}}=\dfrac{14,7}{9,8\%}=150\left(g\right)\\ \sum n_{MgSO_4}=\sum n_{H_2SO_4}=0,15\left(mol\right)\\ \Rightarrow\sum m_{MgSO_4}=0,15\cdot120=18\left(g\right)\\ \Rightarrow C\%_{MgSO_4}=\dfrac{18}{10,4+150-0,1\cdot44}\approx11,54\%\)