Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

m = 9,2 + 2,4 + 9,6 = 21,2 g ---> M = 21,2/0,2 = 106 đvC.
D: NaxCyOz ---> 23x:12y:16z = 9,2:2,4:9,6 ---> x:y:z = 0,4:0,2:0,6 = 2:1:3 ---> D: (Na2CO3)n.
---> 106n = 106 ---> n = 1 ---> D: Na2CO3.

1.
\(M_B=1,25.22,4=28\)
\(m_C:m_H=6:1\)
=>\(n_C:n_H=\frac{6}{12}:\frac{1}{1}=0,5:1=1:2\)
=> CTHH:C2H4
2
\(m_{Ca}:m_N:m_O=10:7:24\)
\(\Rightarrow n_{Ca}:n_N:n_O=\frac{10}{12}:\frac{7}{14}:\frac{24}{16}=0,833:0,5:1,5\)=\(1:2:6\)
\(M_C=\frac{32,8}{0,2}=164\)
=>CTHH:Ca(NO3)2
3
Do hợp chất có 0,2 g
=>\(m_{Na}=9,2.2=18,4\left(g\right)\)
\(m_C=2,4.2=4,8\left(g\right)\)
\(m_{O2}=9,6.2=18,4\)
\(n_{Na}:n_C:n_O=\frac{18,4}{23}:\frac{4,8}{12}:\frac{19,2}{16}=0,8:0,4:1,2=2:1:3\)
CTHH:Na2CO3

a, Gọi CTHH của hợp chất là CuxSyOz
Ta có x:y:z = \(\dfrac{40}{64}:\dfrac{20}{32}:\dfrac{40}{16}\)= 0,625:0,625:2,5
= 1:1:4
Suy ra CTHH của hợp chất A là CuSO4
c, Ta có MC = \(\dfrac{32,8}{0,2}\)= 164(g/mol)
Gọi CTHH của hợp chất C là CaxNyOz
x:y:z = \(\dfrac{10}{40}:\dfrac{7}{14}:\dfrac{24}{16}\)= 0,25:0,5:1,5
= 1:2:6
=> CT đơn giản của h/c là CaN2O6 hay Ca(NO3)2
Ta có : (CaN2O6)n = 164
=> n = 1
Vậy CTHH của h/c C là Ca(NO3)2

- Hợp chất A:
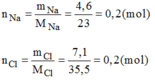
Cứ 0,2 mol hợp chất A có chứa 0,2 mol Na và 0,2 mol Cl.
Suy ra 1 mol hợp chất A có chứa 1 mol Na và 1 mol Cl.
Vậy công thức hóa học đơn giản của A là NaCl.
- Hợp chất B:
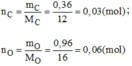
Vậy 0,03mol phân tử B có chứa 0,03 mol phân tử C và 0,06 mol nguyên tử O.
Suy ra 1 mol phân tử B có chứa 1 mol nguyên tử C và 2 mol nguyên tử O.
→Công thức hóa học của B là C O 2
- Hợp chất C:
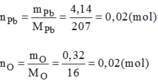
Vậy 0,02 mol phân tử C có chứa 0,02 mol nguyên tử Pb và 0,02 mol nguyên tử O.
Suy ra 1 mol phân tử C có chứa 1 mol nguyên tử Pb và 1 mol nguyên tử O.
→Công thức của phân tử C là: PbO.
- Hợp chất D:
Theo đề bài: 0,04 mol phân tử D có 0,08 mol Fe và 3 mol O.
Vậy 1 mol phân tử D có: 2 mol Fe và 0,12 mol O.
→ Công thức hóa học của D là F e 2 O 3
- Hợp chất E:
Cho biết: 0,02 mol phân tử E có 0,04 mol Na kết hợp 0,02 mol C và 0,06 mol nguyên tử O.
Vậy 1 mol phân tử E co 2 mol Na kết hợp 1 mol C và 3 mol O.
Công thức hóa học của E là N a 2 C O 3 .

Bài 2:
Ta có:
| Nguyên tố | 0,2 mol hợp chất D | 1 mol hợp chất D |
| Na | 9,2(g) | 9,2.5=46(g) |
| C | 2,4(g) | 2,4.5=12(g) |
| O | 9,6(g) | 9,6.5=48(g) |
Trong 1 mol hợp chất D có chứa:
\(n_{Na}=\frac{46}{23}=2\left(mol\right);\\ n_C=\frac{12}{12}=1\left(mol\right);\\ n_O=\frac{48}{16}=3\left(mol\right)\)
Vậy: Hợp chất D nói trên có CTHH là Na2CO3 ( đọc là: natri cacbonat).
Bài 3:
Trong hợp chất cần tìm , khối lượng O bằng:
\(m_O=m_{hợpchất}-m_{Cu}-m_S\\ =160-64-32=64\left(đ.v.C\right)\)
Ta được:
\(n_{Cu}=\frac{64}{64}=1\left(mol\right);\\ n_S=\frac{32}{32}=1\left(mol\right);n_O=\frac{64}{16}=4\left(mol\right)\)
Vậy: CTHH của hợp chất cần tìm là CuSO4 (đọc là: Đồng (II) sunfat).

Hợp chất A
\(n_{Na}=\dfrac{4,6}{23}=0,2mol\\ n_{Cl}=\dfrac{7,1}{35,5}=0,2mol\)
Na + Cl \(\rightarrow\) A
0,2 0,2 0,2 ( mol ) \(\left\{Phần.này.bạn.không.hiểu.thì.hỏi.mình.nhé!\right\}\)
\(\Rightarrow\) 1 1 1 ( mol )
\(\Rightarrow CTHH:NaCl\)
< Mấy cái ở dưới cũng làm tương tự >

nNa = 0.4 mol; nC = 0,2 mol; nO = 0.6 mol
nNa/nD = 0.4/0.2 = 2
nC/nD = 0.2/0.2 = 1
nO/nD = 0.6/0.2 = 3
=> Na2CO3

Bài 3: Giải:
Ta có:
\(n_{Cu}=\frac{6,4}{64}=0,1\left(mol\right);\\ n_{O_2}=\frac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: 2Cu + O2 -> 2CuO
a) Theo PTHH và đề bài, ta có:
\(\frac{0,1}{2}=0,05< \frac{0,15}{1}=0,15\)
=> Cu hết, O2 dư nên tinh theo nCu
Theo PTHH và đề bài, ta có:
\(n_{CuO}=n_{Cu}=0,1\left(mol\right)\)
Khối lượng CuO thu được sau phản ứng:
\(m_{CuO}=0,1.80=8\left(g\right)\)
b) Theo PTHH và đề bài, ta có:
\(n_{O_2\left(phảnứng\right)}=\frac{n_{Cu}}{2}=\frac{0,1}{2}=0,05\left(mol\right)\)
=> \(n_{O_2\left(dư\right)}=0,15-0,05=0,1\left(mol\right)\)
Khối lượng O2 dư:
\(m_{O_2\left(dư\right)}=0,1.32=3,2\left(g\right)\)
Bài 2:
PTHH: 4Al+3O2->2Al2O3
mol 4----3------2
nAl=\(\frac{2,7}{27}\)=0.1 mol ; nAl2O3=\(\frac{2,65}{102}\)≈0.026 mol
Ta có: nAl>2.nAl2O3
⇒Al dư
nAldư=nAlbanđau-nAlpư=0,1-2.0,026=0,048 mol
⇒⇒mAldư=0,048.27=1,296 g
Khối lượng các chất rắn còn lại sau phản ứng là:
mAldư+mAl2O3=1,296+2,65=3,946g

\(m_{Na}=\dfrac{84\cdot27,38}{100}\approx23\left(mol\right)=>n_{Na}=\dfrac{m}{M}=\dfrac{23}{23}=1\left(mol\right)\)
\(m_H=\dfrac{84\cdot1,19}{100}\approx1\left(g\right)=>n_H=\dfrac{m}{M}=\dfrac{1}{1}=1\left(mol\right)\)
\(m_C=\dfrac{14,29\cdot84}{100}\approx12\left(g\right)=>n_C=\dfrac{m}{M}=\dfrac{12}{12}=1\left(mol\right)\)
\(m_O=\dfrac{57,14\cdot84}{100}\approx48\left(g\right)=>n_O=\dfrac{m}{M}=\dfrac{48}{16}=3\left(mol\right)\)
\(=>CTHH:NaHCO_3\)
\(m_{D}=9,2+2,4+9,6=21,2(g)\\ M_D=\frac{21,2}{0,2}=106(g/mol)\\ Na_xC_xO_y\\ x:y:z=\frac{9,2}{23} : \frac{2,4}{12} : \frac{9,6}{16}\\ x:y:z=0,4 : 0,2 : 0,6\\ x:y:z=2:1:3\\ CTDGN: (Na_2CO_3)_n=106\\ (106).n=106\\ n=1 \to Na_2CO_3\)