Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nFe = nH2 = 0,045 mol. Bảo toàn nguyên tố Fe:
nFe3O4 = 0,015 mol
[O] + H2 → H2O.
nH2O = nO = 0,06 mol ⇒ m = 1,08(g)
Đáp án C

Sau khi hỗn hợp X bị CO lấy đi 1 phần oxi ⇒ Chất rắn Y.
+ Đặt nFe/Y = a và nO/Y = b ta có:
PT bảo toàn electron: 3a – 2b = 2nSO2 = 0,09 mol (1)
PT theo muối Fe2(SO4)3: 200a = 18 (2)
+ Giải hệ (1) và (2) ta có: a = b = 0,09 mol
⇒ mY = 0,09×(56+16) = 6,48 gam.
+ Mà nO bị lấy đi bởi CO = nCaCO3 = 0,04 mol
⇒ nX = mY + mO bị lấy đi = 6,48 + 0,04×16 = 7,12 gam
Đáp án B

Đáp án B
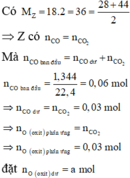
Quy đổi hỗn hợp Y tương ứng với hỗn hợp gồm các kim loại và O dư (a mol)
Có m O = 16 . ( a + 0 , 3 ) gam ⇒ m = 64 a + 1 , 92 ( 1 )
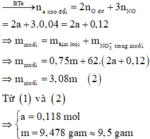
Vậy m gần với giá trị 9,5 nhất
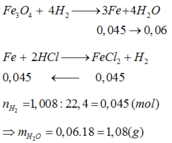

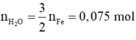

Đáp án C
nFe = nH2 = 0,045 mol. Bảo toàn nguyên tố Fe:
nFe3O4 = 0,015 mol
[O] + H2 → H2O.
nH2O = nO = 0,06 mol ⇒ m = 1,08(g)