Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

gọi kim loại cần tìm là R và nguyên tử khối của KL R là M
Ta có nR = 14,4/M(**)
PTHH :
R +2HCl -->RCl2 +H2(1)
R + H2SO4 --->RSO4 +H2(2)
H2 + CuO --> Cu + H20(3)
nCu=38,4/64=,6 mol
Theo pt(3) => nH2 =nCu= 0,6 mol
Theo PT (1) và (2) : nR =nH2 = 0,6 mol(*)
Từ (*) và (**) ta có 14,4/M =0,6
=> M =14,4/0,6 = 24(đvC)
Vậy kim loại cần tìm là Magie (Mg=24)

a) $Fe + H_2SO_4 \to FeSO_4 + H_2$
b) Ta thấy :
$n_{Fe} = \dfrac{5,6}{56} = 0,1 > n_{H_2SO_4} = \dfrac{1,96}{98} = 0,02$
Do đó Fe dư
$n_{Fe\ pư} = n_{H_2SO_4} = 0,02(mol)$
$m_{Fe\ dư} = 5,6 - 0,02.56 = 4,48(gam)$
c)
$n_{FeSO_4} = n_{H_2SO_4} = 0,02(mol) \Rightarrow m_{FeSO_4} = 0,02.152 = 3,04(gam)$
d)
$n_{H_2} = n_{H_2SO_4} = 0,02(mol)$
$V_{H_2} = 0,02.22,4 = 0,448(lít)$
nFe=5,6/56=0,1(mol)
nH2SO4=1,96/98=0,02(mol)
a) PTHH: Fe + H2SO4 -> FeSO4 + H2
b) Ta có: 0,02/1 < 0,1/1
=> Fe dư, H2SO4 hết => Tính theo nH2SO4.
=> nFe(p.ứ)=nFeSO4=nH2=nH2SO4=0,02(mol)
=>nFe(dư)=0,1 - 0,02=0,08(mol)
c) =>mFe(dư)= 0,08.56=4,48(g)
d) V(H2,đktc)=0,02.22,4=0,448(l)
Chúc em học tốt!

2Al + F e 2 O 3 → A l 2 O 3 + 2Fe
Sau phản ứng cho hỗn hợp rắn tác dụng với dd NaOH thấy có khí thoát ra, suy ra có Al dư.
Vậy hỗn hợp rắn: Fe, A l 2 O 3 , Al (dư) và F e 2 O 3 (nếu dư).
Theo định luật bảo toàn khối lượng, ta có:
m X = m r ắ n tan + m r ắ n k h ô n g tan
= 21,67 - 12,4 = 9,27g
Mà m r ắ n tan = m A l d u + m A l 2 O 3
2Al + 2NaOH + 2 H 2 O
→ 2 N a A l O 2 + 3 H 2 1
Theo PTHH (1), ta có:
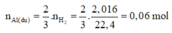
⇒ m A l d u = 0,06.27 = 1,62g
⇒ m A l 2 O 3 p u = m r a n tan - m A l d u
= 9,27-1,62=7,65 g
⇒ n A l 2 O 3 p u = 0,075mol
⇒ n A l p u = n F e s p = 2 n A l 2 O 3 p u
= 0,075.2 = 0,15 mol
Ta có:
m ran khong tan = mFe (sp) = mFe2O3(neu dư)
⇒ m F e 2 O 3 (neu dư)=12,4-0,15.56 = 4g
⇒ n F e 2 O 3 dư = 4/160 = 0,025 mol
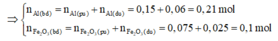
Giả sử phản ứng hoàn toàn thì Al sẽ dư → Tính hiệu suất phản ứng nhiệt nhôm theo F e 2 O 3 .
⇒ H = 0,075.100/0,1 = 75%
⇒ Chọn D.

a) PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
2 mol : 3 mol : 1 mol : 3 mol
0,1 mol <-- 0,15 mol <--- 0,15 mol
số mol của H2 là: 3,36 / 22,4 = 0,15 mol
khối lượng Al là: 0,1 * 27 = 2,7 g
ta có: 8 g chất rắn không tan sau phản ứng là: Cu
vậy khối lượng hỗn hợp a là: mAl + mCu = 2,7 + 8 = 10,7 g
b) khối lượng chất tan của H2SO4 là: mchất tan= 0,15 * 98 = 14,7 g
ta có: C% H2SO4= (mchất tan/ m dung dịch) * 100
→ m dung dịch H2SO4 = ( m chất tan * 100) / C% = ( 14,7 * 100) / 20= 73,5 g

\(n_{H_2}=\dfrac{2,24}{22,4}=0,1(mol)\\ a,PTHH:Zn+H_2SO_4\to ZnSO_4+H_2\)
\(b,\) Vì Cu ko td \(H_2SO_4\) loãng nên chất rắn còn lại sau p/ứ bằng \(m_{Cu}\)
\(n_{Zn}=n_{H_2}=0,1(mol)\\ \Rightarrow m_{Zn}=0,1.65=6,5(g)\\ \Rightarrow m_{\text{rắn dư}}=m_{Cu}=10,5-6,5=4(g)\)
\(n_{FeO\left(bđ\right)}=a\left(mol\right);n_{CuO\left(bđ\right)}=y\left(mol\right)\\ n_{Cu}=\dfrac{0,64}{64}=0,01\left(mol\right)\)
\(\Rightarrow72a+80y=2,28\left(1\right)\)
\(PTHH:\\ FeO+H_2\underrightarrow{t^o}Fe+H_2O\\CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Vì phản 1 thời gian (phản ứng không hoàn toàn) nên sau phản ứng còn FeO, CuO dư. Vậy 1,96g hỗn hợp rắn thu được gồm Fe: x (mol); Cu: 0,01(mol); FeO dư: a - x (mol); CuO dư: y - 0,01 (mol)
Ta có phương trình:
\(56x+0,64+72\left(a-x\right)+80\left(y-0,01\right)=1,96\\ 72a+80y-16x=1,8\left(2\right)\)
\(\left(1\right)\left(2\right)\Rightarrow2,28-16x=1,8\Leftrightarrow x=0,03\left(mol\right)\)
\(\Rightarrow m=m_{Fe}+m_{Cu}=56.0,03+0,64=2,32\left(g\right)\)
ui Thảo hỏi bài trong bài ktra Hoá hôm qua kìa:(