Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phần lớn là tăng vì có một số ít trường hợp khi tăng nhiệt độ thì độ tan lại giảm. VD: Na2SO4

Đáp án : C
2Fe + 1,5O2 -> Fe2O3
2FeCO3 + 0,5O2 -> Fe2O3 + 2CO2
2FeS2 + 5,5O2 -> Fe2O3 + 4SO2
Vì sau phản ứng thì áp suất trong bình không đổi
=> Số mol O2 phản ứng = số mol khí sinh ra
=> 0,75a + 0,25b + 2,75c = b + 2c
=> a +c = b

Vì nhiệt độ không đổi nên độ tăng áp suất = độ tăng thể tích = độ tăng số mol.
2 NH3 --> N2 + 3 H2
Từ 1 mol NH3 ban đầu thì sau phản ứng thu 2 mol hỗn hợp sản phẩm.
Nếu a là số mol NH3 ban đầu thì sau khi phản ứng phân hủy kết thúc thu 1,5a mol sản phẩm tức là số mol tăng lên 0,5a mol.
Như vậy, đã có 0,5a/2 mol NH3 bị phân hủy.
Hiệu suất = 0,25a/a = 0,25 = 25%
Chọn A. 25%

Đáp án C
m A = m C O 2 ; n A = n C O 2 ⇒ M A = M C O 2 = 44 . Công thức của anđehit là R(CHO)n → n < 2.
n = 1 → R = 15 → R là CH3. A là anđehit axetic




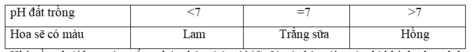
sẽ tăng
Độ tan của chất khí sẽ giảm. Độ tan của chất khí tăng khi ta giảm nhiệt độ và tăng áp suất