Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

A + H2SO4 → Hỗn hợp khí ⇒ Fe dư; khí Y gồm: H2 ( x mol) và H2S (y mol)
⇒ x + y = 0,1 mol (1)
Bảo toàn S: nH2S = nFeS = nS = y mol
nFe dư = nH2 = x
Bảo toàn Fe: nFe = nFeS + nFe dư = x + y
mX = 56(x + y ) + 32y = 7,2g (2)
Từ (1)(2) ⇒ x = 0,05 mol; y = 0,05 mol
MY = mY : nY = (0,05.2 + 0,05.34) : 0,1 = 18 ⇒ dY/H2 = 9
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{FeS}=b\left(mol\right)\end{matrix}\right.\left(đk:a,b>0\right)\)
TH1: S dư
Vậy toàn bộ lượng khí sinh ra là H2S
\(d_{Y\text{/}H_2}=d_{H_2S\text{/}H_2}=\dfrac{34}{2}=17\)
TH2: Fe dư
\(n_{khí}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Bảo toàn KL: \(m_A=m_X=7,2\left(g\right)\)
PTHH:
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a----------------------------->a
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\)
b-------------------------------->b
Ta có hệ phương trình: \(\left\{{}\begin{matrix}56a+88b=7,2\\a+b=0,1\end{matrix}\right.\)
\(\Leftrightarrow a=b=0,05\left(TM\right)\)
\(M_Y=\dfrac{0,05.\left(2+34\right)}{0,1}=18\left(g\text{/}mol\right)\\ \rightarrow d_{Y\text{/}H_2}=\dfrac{18}{2}=9\)

\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\\ n_S=\dfrac{4,8}{32}=0,15\left(mol\right)\)
PTHH: Fe + S --to--> FeS (1)
LTL: \(0,2>0,15\rightarrow\) Fe dư
Theo pthh (1):
\(n_{Fe\left(pư\right)}=n_{FeS}=n_S=0,15\left(mol\right)\\ \rightarrow\left\{{}\begin{matrix}m_{Fe\left(dư\right)}=\left(0,2-0,15\right).56=2,8\left(g\right)\\m_{FeS}=0,15.88=13,2\left(g\right)\end{matrix}\right.\)
PTHH:
FeS + 2HCl ---> FeCl2 + H2S
0,15 0,15
Fe + 2HCl ---> FeCl2 + H2
0,05 0,05
\(\rightarrow M_Z=\dfrac{0,15.34+0,05.2}{0,15+0,05}=26\left(\dfrac{g}{mol}\right)\)
=> dZ/H2 = \(\dfrac{26}{2}=13\)

Ở mỗi phần, Y gồm FeS(x mol), Fe dư(y mol)
Phần 2 :
n H2SO4 = 55.98%/98 = 0,55(mol)
n SO4(trong A) = n BaSO4 = 58,25/233 = 0,25(mol)
Gọi n SO2 = z(mol)
Bảo toàn electron : 9x + 3y = 2z(1)
Bảo toàn S : x + 0,55 = 0,25 + z(2)
Phần 1 :
$Fe + 2HCl \to FeCl_2 + H_2$
$FeS + 2HCl \to FeCl_2 + H_2S$
n H2 = n Fe = y(mol)
n H2S = n FeS = x(mol)
M Z = 13.2 = 26
Suy ra: 34x + 2y = 26(x + y) (3)
Từ (1)(2)(3) suy ra x = 0,075 ; y = 0,025 ; z = 0,375
Suy ra :
1/2 X có :
n Fe = 0,075 + 0,025 = 0,1(mol)
n S = 0,075(mol)
Vậy :
a = (0,1.56 + 0,075.32).2 = 16 gam

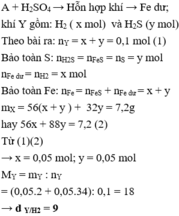
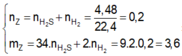
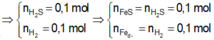
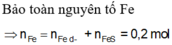
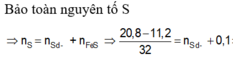
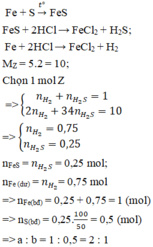
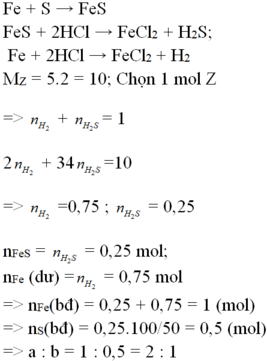
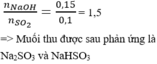
\(Fe+S\underrightarrow{t^o}FeS\)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Do khí sau pư gồm H2, H2S => X chứa FeS, Fe
Fe+S-to>FeS
Fe+2HCl->FeCl2+H2
FeS+2HCl->FeCl2+H2S
=> Vẫn còn S dư