Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án: D
Gọi nCH3COOH = x ; nC2H5OH = y
=> 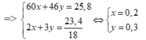
=> % CH3COOH = = 46,5% ; % C2H5OH = 53,5%
Gọi hiệu suất phản ứng este hóa là H.
=> n este = 0,2.H (vì axit hết - theo lí thuyết)
=> meste = 0,2H.88 = 17,6H
Mà meste = 14,08
=> H = 80%

Gọi n C 2 H 5 O H = x ; n C H 3 C O O H = y . Đốt cháy sản phẩm cũng như hỗn hợp ban đầu, theo định luật bảo toàn nguyên tố H ta có:
6 n C 2 H 5 O H + 4 n C H 3 C O O H = 2 n H 2 O
Hay 6x + 4y = 2. 23 , 4 18 = 2,6 (1)
Phương trình theo khối lượng: 46x + 60y = 25,8 (2)
Từ (1) và (2) suy ra: x = 0,3; y = 0,2
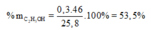
![]()
Theo lý thuyết n e s t e = n a x i t = 0 , 2
⇒ m e s t e = 17 , 6 ( g ) mà thực tế thu được 14,08 (g)
Vậy H = 14 , 08 17 , 6 . 100 % = 80 %
Đáp án D


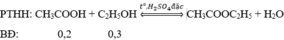
(0,2/1 < 0,3/1 nên hiệu suất tính theo axit)
Pư: 0,2h → 0,2h → 0,2h
Sau: 0,2 - 0,2h 0,3-0,2h 0,2h
=> m este = mCH3COOC2H5 = 14,08 gam
=> 0,2h.88 = 14,08 => h = 0,8 = 80%
Đáp án cần chọn là: D



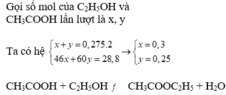

Giải thích:
n H2O = 23,4 : 18 = 1,3 mol ( 1ml = 1g đối với nước )
Đặt số mol của CH3COOH là a , số mol của C2H5OH là b ta có hệ
n este = 14,08 : 88 = 0,16 mol
CH3COOH + C2H5OH→ CH3COOC2H5 + H2O
0,2 0,3 => 0,2 mol ( theo lý thuyết )
Đáp án D