Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi nAl = x (mol), nCu = y (mol); nNO2 = 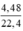 = 0,2 mol
= 0,2 mol
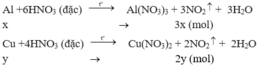
Theo pt: nNO2(1) = 3. nAl = 3.x mol
nNO2(2) = 2. nCu = 2y mol
⇒ Tổng nNO2 = 3x + 2y = 0,2 mol
Ta có hệ phương trình
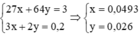
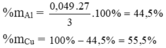

nNO2 =\(\frac{PV}{RT}\)=0,9
\(\begin{cases}27x+24y=9\\3x+2y=0,9\end{cases}\)(1 phương trình về khối lượng và 1 phương trình về bảo toàn e)
<=>\(\begin{cases}x=0,2\\y=0,15\end{cases}\)
=>%mAl =((0,2*27)/9)*100=60%
=>%mMg =40%

Gọi số mol của Cu là x ; số mol của Al là y
\(Cu+HNO3\rightarrow Cu\left(NO3\right)2+NO2+H2O\)
\(Al+HNO3\rightarrow Al\left(NO3\right)3+NO2+H2O\)
Áp dụng bảo toàn e :
\(\left\{{}\begin{matrix}64x+27y=3\\2x+3y=0,2.1\end{matrix}\right.\rightarrow\left\{{}\begin{matrix}x=0,03\\y=0,05\end{matrix}\right.\)
\(\%m_{Cu}=\frac{0,03.64}{3}.100\%=64\%\)
\(\%m_{Al}=100\%-64\%=36\%\)
Gọi $n_{Cu} = a(mol) ; n_{Al} = b(mol) \Rightarrow 64a + 27b = 3(1)$
$Cu^0 \to Cu^{+2} + 2e$
$Al^0 \to Al^{+3} + 3e$
$N^{+5} + 1e \to N^{+4}$
Bảo toàn electron :
$2a + 3b = 0,2(2)$
Từ (1)(2) suy ra $a = \dfrac{3}{115} ; b = \dfrac{17}{345}$
\(\%m_{Cu}=\dfrac{\dfrac{3}{115}.64}{3}.100\%=55,65\%\\ \%m_{Al}=100\%-55,65\%=44,35\%\)
Gọi số mol của Cu và Al lần lượt là x,y (mol) (x,y>0)
\(Cu+4HNO_{3\left(đ\right)}\underrightarrow{to}Cu\left(NO_3\right)_2+2NO_2+2H_2O\\ x..................................2x\left(mol\right)\\ Al+6HNO_{3\left(đ\right)}\underrightarrow{to}Al\left(NO_3\right)_3+3NO_2+3H_2O\\ y...............................3y\left(mol\right)\)
\(\left\{{}\begin{matrix}64x+27y=3\\2x+3y=0,2\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=\dfrac{3}{115}\\y=\dfrac{17}{345}\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%m_{Cu}=\dfrac{\dfrac{3}{115}.64}{3}.100\approx55,652\%\\\%m_{Al}\approx44,348\%\end{matrix}\right.\\ \)