Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Trong tinh thể ion, giữa các ion có lực hút tĩnh điện rất mạnh nên các hợp chất ion thường là chất rắn, khó nóng chảy, khó bay hơi ở điều kiện thường.
Ví dụ: Nhiệt độ nóng chảy của MgO là 2800°C.
- Các hợp chất ion thường tan nhiều trong nước. Khi tan trong nước, các ion bị tách khỏi mạng lưới tinh thể, chuyển động khá tự do và là tác nhân dẫn điện. Ở trạng thái nóng chảy, hợp chất ion dẫn điện.
- Do lực hút tĩnh điện rất mạnh giữa các ion nên các tinh thể ion khá rắn chắc, nhưng khá giòn.
⇒ Đây là tính chất đặc trưng của tinh thể ion.
Một số ứng dụng phổ biến của hợp chất ion trong đời sống:
- Potassium hydroxide là hợp chất ion được dùng làm chất dẫn điện trong pin alkaline (pin kiềm).
- Máy lọc không khí tạo ion âm.

a) Khí H2S và axit sunfuric đặc tham gia các phản ứng oxi hóa – khử thì khí H2S chỉ thể hiện tính khử và H2SO4 đặc chỉ thể hiện tính oxi hóa. Vì trong H2S số oxi hóa của S chỉ có thể tăng, trong H2SO4 số oxi hóa S chỉ có thể giảm.
Vì trong H2S số oxi hóa của S là -2 (là số oxi hóa thấp nhất của S) nên chỉ có thể tăng (chỉ thể hiện tính khử), trong H2SO4 số oxi hóa của S là +6 (là số oxi hóa cao nhất của S) nên chỉ có thể giảm (chỉ thể hiện tính oxi hóa).
b) Phương trình phản ứng hóa học:
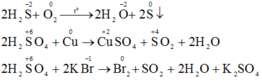

\(1)Mg + Cl_2 \xrightarrow{t^o} MgCl_2\\ 2)Cl_2 + 2NaOH \to NaCl + NaClO + H_2O\\ 3)Cl_2 + 2NaBr \to 2NaCl + Br_2\\ 4)Cl_2 + 2NaI \to 2NaCl + I_2\\ 5)Br_2 + 2NaI \to 2NaBr + I_2\\ 6)Fe + 2HCl \to FeCl_2 + H_2\\ 7)MnO_2 + 4HCl \to MnCl_2 + Cl_2 + 2H_2O\\ 8)Mg + 2HCl \to MgCl_2 + H_2\\ 9)4HF + SiO_2 \to SiF_4 + 2H_2O\)

Dung dịch axit sunfuric loãng có những tính chất chung của axit, đó là:
- Đổi màu quỳ tím thành đỏ.
- Tác dụng với kim loại giải phóng hiđro.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazơ và bazơ
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
- Tính chất với nhiều chất muối
BaCl2 + H2SO4 → BaSO4 +2HCl

So sánh tính chất hóa học của brom với clo và iot.
Brom có tính oxi hóa yếu hơn clo nhưng mạnh hơn iot nên:
Cl2 + 2NaBr → 2NaCl + Br2
Br2 + 2NaI → 2NaBr + I2.

Tính chất hóa học cơ bản của clo: Clo là chất oxi hóa mạnh.
- Tác dụng với kim loại : clo oxi hóa trực tiếp hầu hết các kim loại tạo muối clorua, phản ứng xảy ra ở nhiệt độ thường hoặc không cao lắm, tốc độ nhanh, tỏa nhiều nhiệt.
2Fe + 3Cl2  2FeCl3
2FeCl3
- Tác dụng với hiđro: Phản ứng xảy ra khi chiếu sáng bởi ánh sáng mặt trời:
H2 + Cl2 → 2HCl.
- Tác dụng với nước:
Trong phản ứng với nước, clo vừa là chất oxi hóa vừa là chất khử.
Cl2 + H2O ⇆ HCl + HClO
Sở dĩ có những tính chất hóa học cơ bản trên vì khi tham gia phản ứng, nguyên tử clo dễ nhận thêm 1 electron để thành ion Cl-. Vì vậy tính chất hóa học cơ bản của clo là tính oxi hóa mạnh.

Cl 2 + 2KI → 2KCl + I 2
Br 2 + 2KI → 2KBr + I 2
Vôi sống tác dụng với H 2 O
CaO + H 2 O → Ca OH 2
Iot thăng hoa bám vào đáy bình

Phần lớn iot được dùng để sản xuất ra các dược phẩm khác nhau. Trong cơ thể người, iot có ở tuyến giáp trạng, dưới dạng những hợp chất hữu cơ phức tạp. Nếu thiếu iot, người thường bị bệnh bướu cổ.
Iốt được dùng nhiều trong y khoa, nhiếp ảnh, thuốc nhuộm.
Đây là một trong các nguyên tố vi lượng cần cho sự sống của nhiều sinh vật. Về mặt hoá học, iốt ít hoạt động nhất và có độ âm điện thấp nhất trong các halogen. Mặc dù Astatin được cho là còn ít hoạt động hơn với độ âm điện thấp hơn
Iốt là chất rắn có màu tím thẫm/xám có thể thăng hoa tại nhiệt độ thường tạo ra chất khí màu tím hồng có mùi khó chịu. Chất halogen này có thể tạo thành hợp chất với nhiều nguyên tố hóa học khác, nhưng nó ít hoạt động hơn so với các nguyên tố khác trong nhóm nguyên tố VII và nó có thêm một số tính chất hơi giống kim loại. Iốt có thể hòa tan trong cloroform, cacbon têtraclorua (CCl4), hay carbon đisulfua(CS2) để tạo thành dung dịch màu tím. Nó tan nhẹ trong nước tạo ra dung dịch màu vàng. Màu xanh lam của một chất gây ra khi tương tác với tinh bột chỉ là đặc điểm của nguyên tố tự do.
Iốt có thể oxi hoá được với H2 ở nhiệt độ cao và có mặt chất xúc tác tạo ra khí hidro iotua theo một phản ứng thuận nghịch:
H2 + I2 <-> 2HI
Iốt oxi hóa được nhiều kim loại nhưng phản ứng chỉ xảy ra khi đun nóng hoặc có chất xúc tác.
2Al + 3I2—H2O--> 2AlI3