Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Công thức oxit cao nhất là RO2
Có \(\dfrac{32}{M_R+32}.100\%=53,3\%=>M_R=28\left(Si\right)\)

Đáp án B
Công thức hợp chất khí với hiđro là RH4 => Hóa trị của R trong hợp chất khí với hiđro là 4 => Hóa trị
của R trong oxit cao nhất = 8 - 4 = 4 =>Công thức oxit cao nhất là RO2
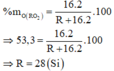
R là Si(silic)

Hợp chất khí với hidro của nguyên tố R là RH2. Oxit cao nhất của nguyên tố R chứa 60% oxi về khối lượng. Xác định nguyên tố R
===============
Hợp chất khí với hidro của nguyên tố R là RH2.
=> công thức với Oxi là RO
=>R/(R+16).100%=60%
<=>R/(R+16)=0,6
<=>0,4R=9,6
<=>R=24
=>R la Mg

Chọn B
Hợp chất khí với Hiđro của một nguyên tố là R H 4 => R có hóa trị IV trong hợp chất khí với H. Hóa trị của R trong hợp chất oxit cao nhất là VIII - IV = IV => Oxit cao nhất là R O 2 .
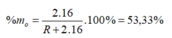
→ R = 28
Vậy R là Si (Silic).

RH4 -> RO2
%R= 53,3% => %O = 100-53,3= 46,7%
\(\dfrac{R}{53,3}\)=\(\dfrac{32}{46,7}\)
giải tìm R


Hợp chất khí với hidro của một nguyên tố là RH4, theo bảng tuần hoàn suy ra công thức oxit cao nhất của R là RO2, trong phân tử RO2 có 53,3% oxit về khối lượng nên R có 100% - 53,3% = 46,7% về khối lượng.
Vậy R là Si. Công thức phân tử là SiH4 và SiO2.