Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Dễ tính nFe=nMg=nCu=0,1 mol
Số mol hh khí=0,12 mol
Khối lượng muối của KL=57,8 gam <58,8
Vậy có NH4NO3 và =1 gam=> nNH4NO3=0,0125 mol
Bảo toàn e ta có:3nFe+2(nMg+nCu)=10nN2+3nNO+nNO2+8nN2O+8nNH4NO3
=>11nN2+3nNO+8nN2O=0,6 mol(1)
Và 2nN2+nNO+nN2O=0,12=> 6nN2+3nNO+3nN2O=0,36(2)
trừ (1) cho (2) ta được 5nN2+5nN2O=0,24
=> nN2+nN2O=0,048 và nNO+nNO2=0,072
Vậy số mol HNO3 = 3nFe + 2(nMg+nCu) + 2(nN2+nN2O) + (nNO2 + nNO) + 2nNH4NO3 = 0,893 mol
=> Đáp án B

Đáp án : A
.nFe = nAl = nMg = 0,24 mol
Vì HNO3 dư nên tạo muối Fe3+. Nếu có NH4NO3 thì :
=> nNH4NO3 = 0,075 mol
Vì N2 và NO2 có số mol bằng nhau => qui về NO và N2O
Bảo toàn e : 8nNH4NO3 + 3nNO + 8nN2O = 3nAl + 3nFe + 2nMg
=> 3nNO + 8nN2O = 1,32 mol
Mtb (NO,N2O) = 37g
=> nNO = nN2O = 0,12 mol
=> nHNO3 pứ = 10nNH4NO3 + 4nNO + 10nN2O = 2,43 mol

Chọn A
Giả sử sau phản ứng có x mol NH4NO3. Ta có:
Quá trình cho e:
Mg → Mg+2 +2e
Al → Al+3 +3e
Zn → Zn+2 +2e
Quá trình nhận e: N+5 → N+1 - 4e
N+5 → N+2 - 3e
N+5 → N-3 - 8e
DLBT e : 2nMg + 3nAl + 2nZn = 8nN2O + 3nNO + 8nNH4NO3
→ m muối = mKL + mNO3-(muối KL) + mNH4NO3
nNO3- (muối KL)= ne trao đổi
→157,05 = 31,25 + 62(8.0,1+3.0,1+8x) + 80x
x= 0,1 mol → nHNO3 đã bị khử = 2nN2O + nNO +nNH4NO3= 0,4 mol

Khối lượng muối nitrat kim loại = 30 + 0,1 x 8 x 62 + 0,1 x 3 x 62 = 98,2 gam
--> m NH4NO3 = 127 - 98,2 = 28,8 gam
--> n NH4NO3 = 28,8/80 = 0,36 mol
--> n HNO3 bị khử = 2n N2O + n NO + n NH4NO3 = 0,1 x 2 + 0,1 + 0,36 = 0,66 mol.
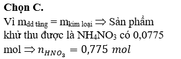

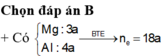
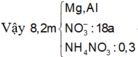

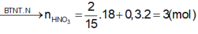

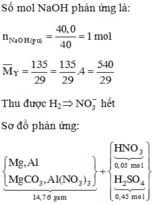
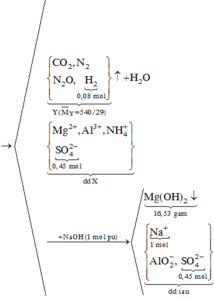
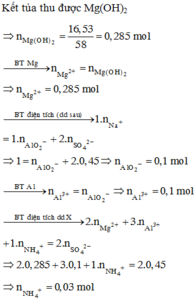
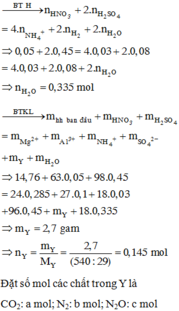

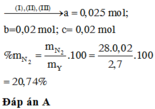
Chọn A
mKL = 0,1.24 + 0,04.27 + 0,15.65 = 13,23 (g) đúng bằng khối lượng dung dịch tăng
=> KL + HNO3 chỉ tạo muối NH4+
=> nNH4+ = 1/8 ne(KL nhường) = 1/ 8 . ( 0,1.2 + 0,04.3 + 0,15.2) = 0,0775 (mol)
=> nHNO3 PƯ = 10nNH4+ = 0,775 (mol)