Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{N_2}=a,n_{H_2}=b\\ M_A=\dfrac{28a+2b}{a+b}=7,2\\ a=4b\\ PT:\dfrac{1}{2}N_2+\dfrac{3}{2}H_2-Fe,t^{^0}->NH_3\\ CuO+H_2-t^{^0}->Cu+H_2O\\ n_{Cu}=n_{H_2dư}=\dfrac{32,64}{64}=0,51mol\\ n_{H_2pư}=b-0,51\left(mol\right)\\ H=\dfrac{b-0,51}{b}=0,2\\ b=0,6375\\ a=2,55\\ V_A=22,4\left(0,6375+2,55\right)=71,4L\)

Đáp án D
Đặt nH2= nN2= a mol (ban đầu)
→ Tổng số mol khí ban đầu n1= a+a=2a (mol)
Do  nên hiệu suất tính theo H2
nên hiệu suất tính theo H2
Đặt nH2 pứ= x mol
N2 + 3H2 ⇌ 2NH3
Ban đầu a a mol
Phản ứng x/3 x 2x/3 mol
Sau pứ (a-x/3) (a-x) 2x/3 mol
Tổng số mol khí sau phản ứng n2= (a-x/3) + (a-x) + 2x/3= 2a- 2x/3 (mol)
Trong cùng điều kiện về nhiệt độ, tỉ lệ số mol bằng tỉ lệ áp suất


Giả sử nN2 = 1mol ⇒ nH2 = 4 mol
N2 + 3H2 → 2NH3
a 3a 2a
Thể tích khí sau phản ứng là: 5 – 4a + 2a = 5 – 2a
B có 20% NH3 theo thể tích ⇒ 2a : (5 – 2a) = 0,2
⇒ a = 0,4167 ⇒ H = 41,67%
Đáp án C.
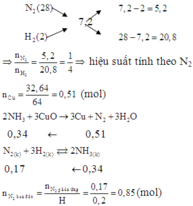
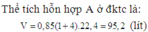

Đáp án A
Định hướng tư duy giải