Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A.
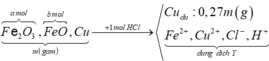
X + HCl dư → FeCl2 + CuCl2 + HCl (dư) + H2O + Cu (dư),
||⇒ quy đổi quá trình → X gồm FeO (tạo FeCl2) + CuO (tạo CuCl2) + Cu (dư).
a mol FeO + b mol CuO + 0,27m Cu; trong đó ∑nO trong oxit = 0,01m (mol).
⇒ giải: a + b = 0,01m và 72a + 80b = m – 0,27m ||⇒ a = 0,00875m và b = 0,0125m.
Giải còn lại, ta gọi nFeCl2 = 7x mol → nCuCl2 = x mol → nHCl dư = 1 – 16x) mol.
Gộp quá trình:
(FeCl2, CuCl2, HCl) + AgNO3 → AgCl 1,0 mol) + (Fe(NO3)3; Cu(NO3)2) + NO + H2O.
165,1 gam tủa gồm Ag và AgCl nhưng về mặt nguyên tố gồm 1 mol Cl → còn lại là 1,2 mol Ag.
nNO = nHCl ÷ 4 = 0,25 – 4x) mol; lại có nFe(NO3)3 = 7x mol; nCu(NO3)2 = x mol
⇒ bảo toàn nguyên tố N có: 21x + 2x + 0,25 – 4x) = 1,2 ⇒ x = 0,25 mol.
Theo đó: m = 800b = 800x = 40 gam.


Khi cho X tác dụng với HCl và dung dịch Y tác dụng với AgNO3 thì ta có hệ sau:
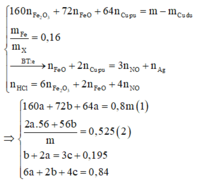
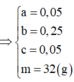
Đáp án B

Đáp án B
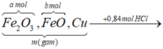
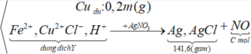
Xét hỗn hợp kết tủa ta có: nAgCl = nHCl = 0,84 mol
=> ![]()
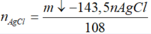
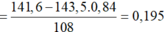
Khi cho X tác dụng với HCl và dung dịch Y tác dụng với AgNO3 thì ta có hệ sau:
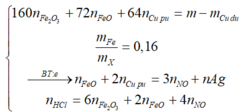
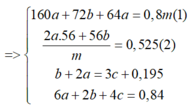
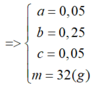

Đáp án B
Dung dịch Y chứa Fe2+ (x mol), Cu2+ (y mol), H+ , Cl- (1 mol).
Khi cho Y tác dụng với dung dịch AgNO3 thì:
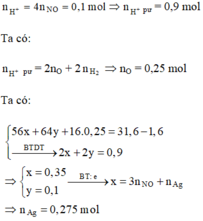
Kết tủa thu được gồm AgCl (1 mol) và Ag (0,275 mol)
=> m = 173,2 (g)
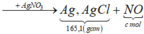
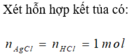
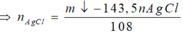
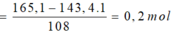

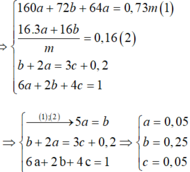
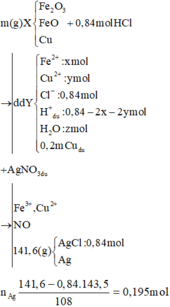




Đáp án A
Còn Cu dư nên Y không có Fe3+
nHCl = 1,25 (mol)
Đặt nO = x (mol) => nH+ phản ứng = 2x (mol)
=> nH+ dư = 1,25 – 2x
nNO = nH+ dư / 4 = 0,3125 – 0,5x
nAgCl = 1,25 => nAg = (211,7 – 1,25.143,5)/108 = 0,2125 (mol)
Bảo toàn electron: nFe2+ = 3nNO + nAg
=> nFe2+ = 1,15 – 1,5x
nCl- trong muối = nH+ phản ứng = 2x (mol)
Bảo toàn điện tích cho muối: 2nFe2+ + 2nCu2+ = nCl-
=> nCu2+ = 2,5x – 1,15
m = 16x/20% = 80x => mCudư =8% m = 64x
=> 80x = 56 ( 1,15 -1,5x) + 64 (2,5x – 1,15) + 6,4x + 16x
=> x = 0,5
=> m = 80x = 40