Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi số mol Fe2O3, MgO là a, b (mol)
nO = 3a + b (mol)
%mO = ( 48a + 16b : 160a + 40b) . 100% = 32%
=> a = b
=> a : b = 1 : 1
Vậy tỉ lệ số mol của Fe2O3 và MgO tương ứng là 1 : 1.
Gọi số mol Fe2O3, MgO là a, b (mol)
nO = 3a + b (mol)
%mO=48a+16b160a+40b.100%=32%%��=48�+16�160�+40�.100%=32%
=> a = b
=> a : b = 1 : 1

a) \(n_{Fe_2\left(SO_4\right)_3}=\dfrac{20}{400}=0,05\left(mol\right)\)
=> \(\left\{{}\begin{matrix}n_{Fe}=0,1\left(mol\right)\\n_S=0,15\left(mol\right)\\n_O=0,6\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}m_{Fe}=0,1.56=5,6\left(g\right)\\m_S=0,15.32=4,8\left(g\right)\\m_O=0,6.16=9,6\left(g\right)\end{matrix}\right.\)
b) \(n_{C_2H_6O}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
=> \(\left\{{}\begin{matrix}n_C=0,6\left(mol\right)\\n_H=1,8\left(mol\right)\\n_O=0,3\left(mol\right)\end{matrix}\right.\) => \(\left\{{}\begin{matrix}m_C=0,6.12=7,2\left(g\right)\\m_H=1,8.1=1,8\left(g\right)\\m_O=0,3.16=4,8\left(g\right)\end{matrix}\right.\)
c) Gọi số mol Fe2O3, MgO là a, b (mol)
=> 160a + 40b = 25
nO = 3a + b = \(\dfrac{25.32\%}{16}=0,5\) (mol)
=> a = 0,125 (mol); b = 0,125 (mol)
=> \(\left\{{}\begin{matrix}n_{Fe}=0,25\left(mol\right)\\n_{Mg}=0,125\left(mol\right)\\n_O=0,5\left(mol\right)\end{matrix}\right.\) => \(\left\{{}\begin{matrix}m_{Fe}=0,25.56=14\left(g\right)\\m_{Mg}=0,125.24=3\left(g\right)\\m_O=0,5.16=8\left(g\right)\end{matrix}\right.\)
a. Số mol sắt (III) sunfat Fe2(SO4)3 là 20/400=0,05 (mol).
mFe=0,05.2.56=5,6 (g), mS=0,05.3.32=4,8 (g), mO=0,05.3.4.16=9,6 (g).
b. Số mol khí C2H6O (ở đktc) là 6,72/22,4=0,3 (mol).
mC=0,3.2.12=7,2 (g), mH=0,3.6=1,8 (g), mO=0,3.16=4,8 (g).
c. Gọi x (mol) và y (mol) lần lượt là số mol của Fe2O3 và MgO.
160x+40y=25 (1).
\(\dfrac{3x.16+16y}{25}=32\%\) \(\Rightarrow\) 48x+16y=8 (2).
Giải hệ phương trình gồm (1) và (2), ta suy ra x=0,125 (mol) và y=0,125 (mol).
mFe=0,125.2.56=14 (g).
mMg=0,125.24=3 (g).
mO=(0,125.3+0,125).16=8 (g).

\(a)V_{dd\ axit} = a(lít)\\ n_{HCl} = 0,4a(mol) ; n_{H_2SO_4} = 0,1a(mol)\Rightarrow n_{H^+} = 0,4a + 0,1a.2 =0,6a(mol)\\ n_O = \dfrac{37,5.64\%}{16} = 1,5(mol)\\ 2H^+ + O^{2-} \to H_2O\\ \Rightarrow 1,5.2 = 0,6a \Rightarrow a = 5(lít)\\ b) n_{H_2O} = \dfrac{1}{2}n_{H^+} = 0,5.0,6.5 = 1,5(mol)\)
Bảo toàn khối lượng :
\(m_{muối} = 37,5 + 0,4.5.36,5 + 0,1.5.98 - 1,5.18 = 132,5(gam)\)

a) \(n_{MgO}=\dfrac{16}{40}=0,4\left(mol\right)\)
=> nMg = 0,4 (mol)
=> mMg = 0,4.24 = 9,6 (g)
b)
Có: nMg : nX = 2 : 3
Mà nMg = 0,4 (mol)
=> nX = 0,6 (mol)
mX = 33,6 - 9,6 = 24 (g)
=> \(M_X=\dfrac{24}{0,6}=40\left(g/mol\right)\)
=> X là Ca
c)
PTHH: 2Mg + O2 --to--> 2MgO
0,4->0,2
2Ca + O2 --to--> 2CaO
0,6->0,3
=> \(m_{O_2}=\left(0,2+0,3\right).32=16\left(g\right)\)
\(V_{O_2}=\left(0,2+0,3\right).22,4=11,2\left(l\right)\)
=> Vkk = 11,2.5 = 56 (l)
a) nMgO=1640=0,4(mol)nMgO=1640=0,4(mol)
=> nMg = 0,4 (mol)
=> mMg = 0,4.24 = 9,6 (g)
b Có: nMg : nX = 2 : 3
Mà nMg = 0,4 (mol)
=> nX = 0,6 (mol)
mX = 33,6 - 9,6 = 24 (g)
=> MX=240,6=40(g/mol)MX=240,6=40(g/mol)
=> X là Ca
c PTHH: 2Mg + O2 --to--> 2MgO
0,4->0,2
2Ca + O2 --to--> 2CaO
0,6->0,3
=> mO2=(0,2+0,3).32=16(g)mO2=(0,2+0,3).32=16(g)
VO2=(0,2+0,3).22,4=11,2(l)VO2=(0,2+0,3).22,4=11,2(l)
=> Vkk = 11,2.5 = 56 (l)

Gọi số mol của Al2O3, Fe2O3 là 2a, 3a (mol)
PTHH: Al2O3 + 3H2SO4 --> Al2(SO4)3 + 3H2O
2a---->6a
Fe2O3 + 3H2SO4 --> Fe2(SO4)3 + 3H2O
3a----->9a
=> 6a + 9a = 0,3
=> a = 0,02
=> \(\left\{{}\begin{matrix}n_{Al_2O_3}=0,04\left(mol\right)\\n_{Fe_2O_3}=0,06\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}\%m_{Al_2O_3}=\dfrac{0,04.102}{0,04.102+0,06.160}.100\%=29,825\%\\\%m_{Fe_2O_3}=\dfrac{0,06.160}{0,04.102+0,06.160}.100\%=70,175\%\end{matrix}\right.\)

\(2Mg+O_2-^{t^o}\rightarrow2MgO\\ 2Cu+O_2-^{t^o}\rightarrow2CuO\\ Đặt:\left\{{}\begin{matrix}m_{Mg}=x\left(g\right)\\m_{Cu}=y\left(g\right)\end{matrix}\right.\\\Rightarrow\left\{{}\begin{matrix}n_{Mg}=\dfrac{x}{24}\left(mol\right)\\n_{Cu}=\dfrac{x}{64}\left(mol\right)\end{matrix}\right.\\ TheoPT:\Rightarrow\left\{{}\begin{matrix}n_{MgO}=\dfrac{x}{24}\left(mol\right)\\n_{CuO}=\dfrac{x}{64}\left(mol\right)\end{matrix}\right.\\ Tacó:\left\{{}\begin{matrix}x+y=24\\\dfrac{x}{24}.40=25\%.\left(\dfrac{x}{24}.40+\dfrac{y}{64}.80\right)\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}x=12\\y=12\end{matrix}\right.\)

$n_{Mg}+n_{Fe}=n_X=0,3$
Mà $n_{Mg}:n_{Fe}=2:1$
$\to n_{Mg}=2n_{Fe}$
$\to 2n_{Fe}+n_{Fe}=0,3$
$\to n_{Fe}=0,1(mol)$
$\to n_{Mg}=0,2(mol)$
$\to m_{hỗn\,hợp}=0,2.24+0,1.56=10,4(g)$
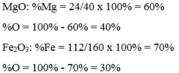
Gọi số mol Fe2O3, MgO là a, b (mol)
nO = 3a + b (mol)
\(\%m_O=\dfrac{48a+16b}{160a+40b}.100\%=32\%\)
=> a = b
=> a : b = 1 : 1