Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

`2Fe + 6H_2 SO_[4(đ,n)] -> Fe_2(SO_4)_3 + 3SO_2 \uparrow + 6H_2 O`
`0,05` `0,15` `0,025` `(mol)`
`Cu + 2H_2 SO_[4(đ,n)] -> CuSO_4 + SO_2 \uparrow + 2H_2 O`
`0,225` `0,45` `0,225` `(mol)`
`n_[SO_2]=[6,72]/[22,4]=0,3(mol)`
Gọi `n_[Fe]=x` ; `n_[Cu]=y`
`=>` $\begin{cases} \dfrac{3}{2}x+y=0,3\\56x+64y=17,2 \end{cases}$
`<=>` $\begin{cases}x=0,05\\y=0,225 \end{cases}$
`@m_[Fe_2(SO_4)_3]=0,025.400=10(g)`
`@m_[CuSO_4]=0,225.160=36(g)`
`@m_[dd H_2 SO_4]=[(0,15+0,45).98]/80 .100=73,5(g)`
Sửa đề: 80% ---> 98% (80% chưa đặc nên không giải phóng SO2 được)
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Cu}=b\left(mol\right)\end{matrix}\right.\)
\(\rightarrow56a+64b=17,2\left(1\right)\)
PTHH:
\(2Fe+6H_2SO_{4\left(đặc,nóng\right)}\rightarrow Fe_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)
a------>3a------------------->0,5a--------------->1,5a
\(Cu+2H_2SO_{4\left(đặc,nóng\right)}\rightarrow CuSO_4+SO_2\uparrow+2H_2O\)
b----->2b------------------->b------------->b
\(\rightarrow1,5a+b=\dfrac{6,72}{22,4}=0,3\left(2\right)\)
Từ \(\left(1\right)\left(2\right)\rightarrow\left\{{}\begin{matrix}a=0,05\left(mol\right)\\b=0,225\left(mol\right)\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}m_{Fe_2\left(SO_4\right)_3}=0,5.0,05.400=10\left(g\right)\\m_{CuSO_4}=0,225.160=36\left(g\right)\\m_{ddH_2SO_4}=\dfrac{\left(0,05.3+0,225.2\right).98}{98\%}=60\left(g\right)\end{matrix}\right.\)

gọi x và y lần lượt là số mol của Fe và Zn ( x không âm)
\(2Fe+6H_2SO_{4\left(đ,n\right)}\rightarrow Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
x-------> 3x------------> 0,5x------------>1,5x------>3x
\(Zn+2H_2SO_{4\left(đ,n\right)}\rightarrow ZnSO_4+SO_2+2H_2O\)
y------->2y---------------->y-------->y------>2y
\(nSO_2=\dfrac{2,8}{22,4}=0,125\left(mol\right)\)
\(\left\{{}\begin{matrix}56x+65y=6,05\\1,5x+y=0,125\end{matrix}\right.\)
=> x = 0,05 ; y = 0,05
=> \(m_{Fe}=0,05.56=2,8\left(g\right)\)
=> \(\%m_{Fe}=\dfrac{2,8.100}{6,05}=46,28\%\)
=> \(\%m_{Zn}=100\%-46,28\%=53,72\%\)

Câu 1. cho 7,36 gam hỗn hợp X gồm Fe và MgO tác dụng với dung dịch H2SO4 đặc nóng, dư. Sau phản ứng thu được dd Y và 2,016 lít khí SO2 (đktc, sản phẩm khử duy nhất). Tính phần trăm khối lượng từng chất trong hỗn hợp X?
Giải
2Fe + 6H2SO4 đ,n => Fe2(SO4)3 + 3SO2 + 6H2O
MgO + H2SO4 đ,n => MgSO4 + H2O
nSO2 = V/22.4 = 2.016/22.4 = 0.09 (mol)
Theo pt => nFe = n.M = 0.06 (mol)
mFe = n.M = 0.06 x 56 = 3.36 (g)
% m Fe = 3.36x100/7.36 = 45.65 %
% m MgO = 100 - 45.65 = 54.35 %
Câu 2. cho m gam hỗn hợp X gồm Cu và Fe2O3 tác dụng với dd H2SO4 đặc nóng, vừa đủ. Sau phản ứng thu được dd Y và 1,12 lít khí SO2 (đktc, sản phẩm khử duy nhất). Cô cạn dd Y được 20 gam muối khan. Tính giá trị m?
Giải
Cu + 2H2SO4 đ,n => CuSO4 + SO2 + 2H2O
Fe2O3 + 3H2SO4 đ,n = >Fe2(SO4)3 +3H2O
nSO2 = V/22.4 = 1.12/22.4 = 0.05 (mol)
Theo pt => nCuSO4 = 0.05 (mol)
mCuSO4 = 0.05x160 = 8 (g)
=> mFe2(SO4)3 = 20 - 8 = 12 (g)
=> nFe2(SO4)3 = 12/400= 0.03 (mol) = nFe2O3
==> mCu = n.M = 0.05 x 64 = 3.2 (g)
==> mFe2O3 = n.M = 0.03x160 = 4.8 (g)
Vậy m = 3.2 + 4.8 = 8 (g)
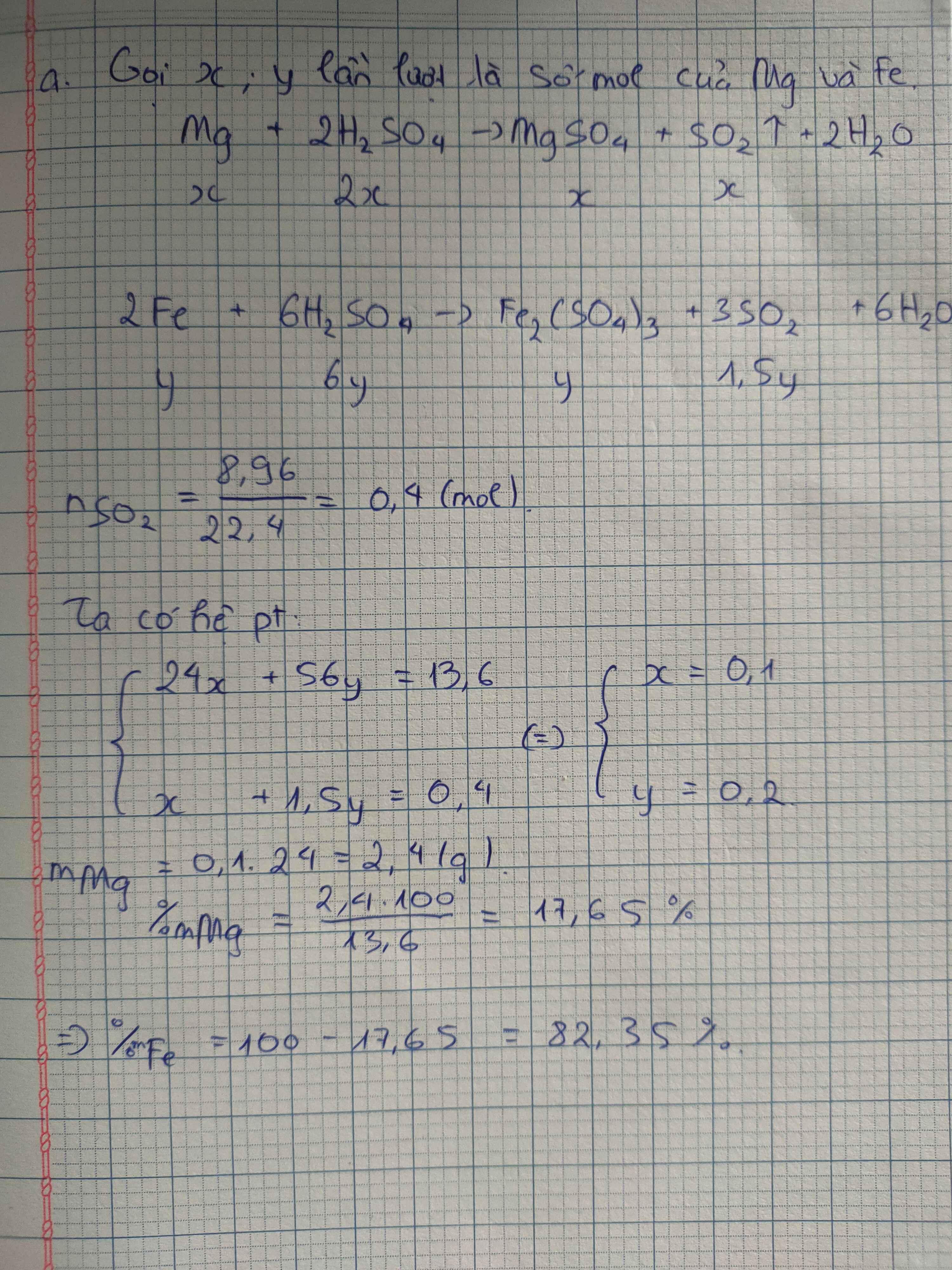


a) n Fe = a(mol) ; n Cu = b(mol) ; n SO2 = 16/64 =0,25(mol)
56a + 64b = 12
Bảo toàn e : 3a + 2b = 0,25.2 = 0,5
Suy ra a =b = 0,1
%m Fe = 0,1.56/12 .100% =46,67%
%m Cu = 100% -46,67% = 53,33%
b)
Thiếu dữ kiện (thiếu nồng độ mol của KOH)
Theo gt ta có: $n_{SO_2}=0,25(mol)$
a, Gọi số mol Fe và Cu lần lượt là a;b(mol)
$\Rightarrow 56a+64b=12$
Bảo toàn e ta có: $3a+2b=0,5$
Giải hệ ta được $a=0,1;b=0,1$
Suy ra $\%m_{Fe}=46,67\%;\%m_{Cu}=53,33\%$
b, Ta có: $m_{dd}=94(g)$
$\Rightarrow \%C_{Fe_2(SO_4)_3}=21,27\%;\%C_{CuSO_4}=17,02\%$
Đề bạn thiếu nồng độ mol của KOH nên không tìm được lượng H2SO4 dư nhé!